
| A、Cl2是氧化剂,NaOH是还原剂 |
| B、氧化剂与还原剂物质的量比为1:5 |
| C、Cl2既做氧化剂又做还原剂 |
| D、3molCl2完全反应电子转移5mol |
| 5 |
| 6 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验次数 | V(NaOH) | V(HCl)/mL | c(NaOH) | ||
| ml | 初读数 | 终读数 | 体积 | mol/L | |
| 1 | 16.02 | 0.00 | 16.69 | 16.69 | 0.1042 |
| 2 | 16.71 | 0.00 | 17.90 | 17.90 | |
| 3 | 19.52 | 0.00 | 20.79 | 20.79 | 0.1065 |
| 4 | 14.99 | 0.00 | 16.02 | 16.02 | 0.1069 |
查看答案和解析>>
科目:高中化学 来源: 题型:
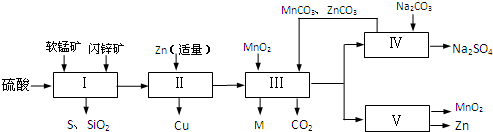
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
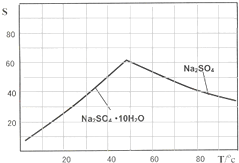
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿伏加德罗常数NA是0.012 kg l2C中所含的原子数 |
| B、2g氢气所含氢原子数目为NA |
| C、标准状况下,11.2 L NH3所含的原子数目为0.5 NA |
| D、含71 g Na2SO4的溶液中所含Na+离子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5%H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中产生气泡量减少;试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5%H2O2溶液和5mL 10%H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
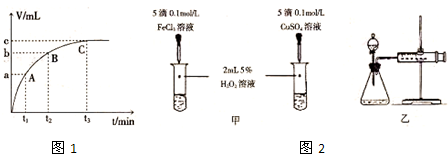
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下: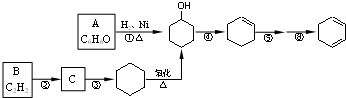
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com