
下列关于乙炔制取的说法不正确的是 ( )
A.为了加快反应速率可用饱和食盐水代替水反应
B.此反应是放热反应
C.反应中不需加碎瓷片作沸石
D.为了除去杂质气体,除了用硫酸铜外还可用氢氧化钠溶液
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列关于化学反应速率的说法,错误的是( )
A.化学反应速率通常用单位时间内反应物浓度的增加量或生成物浓度的减少量B.化学反应速率的数值无负值,均为正值
C.不能用固体或纯液体的浓度变化量表示化学反应速率
D.化学反应速率的单位是mol/(L·s)或mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
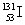 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中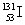 的含量变化来监测核电站是否发生放射性物质泄漏。下列有关
的含量变化来监测核电站是否发生放射性物质泄漏。下列有关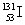 的叙述中错误的是( )
的叙述中错误的是( )
A.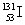 的化学性质与
的化学性质与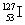 相同
相同
B.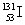 的原子序数为53
的原子序数为53
C.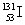 的原子核外电子数为78
的原子核外电子数为78
D.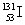 的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A、B、C、D的名称分别是________、________、________、________。
(2)A的离子结构示意图是________,C的原子结构示意图是________。
(3)C的最高价氧化物对应的水化物与A的氢氧化物生成__ __种盐,
其生成的正盐的化学式为____ ___。
(4)D的气态氢化物的电子式___ _____、A的氢氧化物的电子式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做乙醛还原性的实验,取l mol/L的硫酸铜溶液2 mL和0.4mol/L的氢氧化钠溶液 4 mL,在一支试管里混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀生成,实验失败的原因是 ( )
A.氧氧化钠的量不够 B.硫酸铜的量不够 C.乙醛溶液太少 D.加热时间不够
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H 
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是 ;若用含同位素18O的乙醇分子与乙酸反应,写出能表示18O 位置的化学方程式: 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,最高价氧化物的水化物的碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为
、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
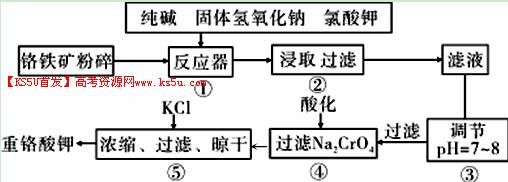
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于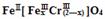 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5 ,a = 10 C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com