
| A、Fe3+ |
| B、MnO4- |
| C、Cl2 |
| D、KIO3 |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同体积的酸中和氢氧化钠的量相同 |
| B、相同体积的酸分别稀释成相同PH溶液,所加水的量相同 |
| C、相同体积的酸与足量锌粒反应产生氢气的量相同 |
| D、两种酸溶液中阴离子总浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯锌与硫酸反应时,加入少量CuSO4溶液,可使反应速率加快 |
| B、甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH-+6e-=CO2+5H2O |
| C、电解饱和食盐水制烧碱,NaOH在阳极区域产生 |
| D、用明矾净水是因为Al3+与OH-生成的Al(OH)3胶粒具有很强的吸附性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
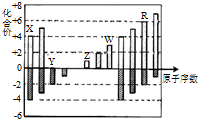
| A、原子半径:Z>W>Y |
| B、Z和Y形成的化合物是离子化合物 |
| C、气态氢化物的稳定性:R<Y |
| D、常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B、铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| C、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、840mL | B、84mL |
| C、560mL | D、56mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| B、第二周期元素从左到右,最高正价从+1递增到+7 |
| C、同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| D、同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com