
描述或解释下列现象的离子方程式,不正确的是
A.向烧碱溶液中滴加石蕊试液,溶液呈蓝色,然后通CO2至颜色变红:
CO2+H2O H++HCO
H++HCO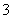
B.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2
C.碳酸氢铵溶液中加足量石灰水:
NH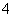 +HCO
+HCO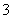 +Ca2++2OH-===CaCO3↓+NH3·H2O+H2O
+Ca2++2OH-===CaCO3↓+NH3·H2O+H2O
D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl-+ClO-+2H+===Cl2↑+H2O
科目:高中化学 来源: 题型:
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是( )
A. CaO2具有氧化性,对面粉可能具有增白作用
B. CaO2中阴阳离子的个数比为1:1
C. CaO2和水反应时,每产生1 mol O2转移电子4 mol
D. CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个化学方程式并配平。
+ 
 + + + H2O
+ + + H2O
(2)反应物中发生氧化反应的物质 ,被还原的元素是 。
(3)反应中1 mol氧化剂得到 mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水的
④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水中
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.某液体物质的摩尔质量大于18g/mol,则该物质密度一定比水大
B.同温同压下,分别将充满HCl、NO2的两支试管倒立于蒸馏水中足够长时间,假设不考虑溶质扩散,两支试管中溶液的物质的量浓度之比为3:2
C.将90 % H2SO4溶液与10 % H2SO4溶液等体积混合,其质量分数一定等于50 %
D.c mol/L KCl溶液的密度为ρg/cm3,则此KCl溶液的质量分数为(74.5c/1000ρ)×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
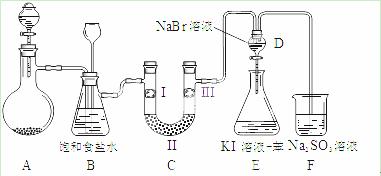
⑴制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: ▲ 。
装置B中饱和食盐水的作用是_____▲ ____;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_____▲____。
⑵装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入__▲__。
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
⑶设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为__▲__色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是___________▲____________。
⑷装置F中用足量的Na2SO3溶液吸收余氯,试写出相应的离子反应方程式:___▲___。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A. 金属阳离子一定只具有氧化性
B. 金属单质作反应物时一定不是氧化剂
C. 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
D. 氧化还原反应中的反应物,不是氧化剂就是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
登山运动员常利用氢化钙固体作为能源提供剂。某兴趣小组用纯净干燥的氢气和金属钙制取氢化钙,所选装置图如下:

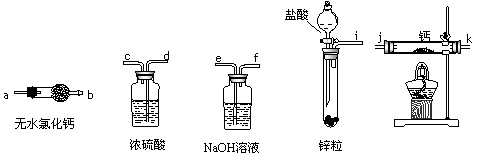

A B C D E
图1
查阅资料:①钙易与水反应生成碱和气体。
②氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。
(1)请按气流方向连接顺序i接( ),( )接( ),( )接( ),k接 a
(填仪器接口的字母编号)。
(2)装置A的作用是 ;装置C的作用是 。
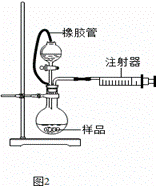 (3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞, (请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间 ②收集气体并检验其纯度
③关闭分液漏斗活塞 ④停止加热,充分冷却
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度。请完善下列实验步骤。
①样品称量 ②加入足量的________溶液(填化学式),搅拌、过滤 ③_______、________(填操作名称) ④称量碳酸钙的质量
(5)乙同学利用图2装置测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00 mL刻度处,反应结束后充分冷却,活栓最终停留在57.04 mL刻度处。(上述气体体积均在标准状况下测定)
试通过计算求样品中氢化钙的纯度: 。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示。已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是 ( )
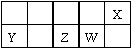 A.原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
B.Z的最高价氧化物的水化物酸性比W的强
C.X的简单气态氢化物的稳定性比W的弱
D.X分别与Y、Z形成的化合物中化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com