
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
【答案】 Fe2O3+3CO![]() 2Fe+3CO2 取少量粉末放于试管中,加少量盐酸,若产生无色无味气体,则证明生成了单质铁 收集CO,防止污染空气 先停止加热,防止生成的铁再次被氧化
2Fe+3CO2 取少量粉末放于试管中,加少量盐酸,若产生无色无味气体,则证明生成了单质铁 收集CO,防止污染空气 先停止加热,防止生成的铁再次被氧化
【解析】(1)CO还原氧化铁生成CO2和铁,据此书写;
(2)根据铁是活泼的金属能与盐酸反应产生氢气解答;
(3)根据CO有毒以及生成的铁在高温下易被氧化分析。
(1)CO还原氧化铁生成CO2和铁,因此得到单质铁的化学方程式为Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(2)铁是活泼的金属能与盐酸反应产生氢气,因此验证生成了单质铁的实验方案为取少量粉末放于试管中,加少量盐酸,若产生无色无味气体,则证明生成了单质铁。
(3)由于CO是有毒气体,需要尾气处理,所以装置末端气球的作用为收集CO,防止污染空气。高温下铁易被空气氧化,所以实验结束时,应先停止加热,冷却后再停止通入CO,目的是防止生成的铁再次被氧化。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除工业废气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)早期是利用NH3还原法,可将NOx还原为N2进行脱除。
已知:①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.9kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180kJ·mol-1
2NO(g) ΔH=+180kJ·mol-1
③H2O(g)![]() H2O(l) ΔH=-44kJ·mol-1
H2O(l) ΔH=-44kJ·mol-1
写出常温下,NH3还原NO反应的热化学方程式__。
(2)以漂粉精溶液为吸收剂可以有效脱除烟气中的NO。
①漂粉精溶液的主要成分是Ca(ClO)2,若吸收过程中,消耗的Ca(ClO)2与吸收的NO的物质的量之比为3∶4,则脱除后NO转化为__。
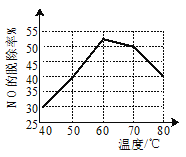
②某一兴趣小组研究不同温度下相同浓度漂粉精溶液对NO脱除率的影响,结果如图所示。图中,40~60℃NO脱除率上升可能的原因为__;60~80℃NO脱除率下降可能的原因为__。
(3)过硫酸钠(Na2S2O8)氧化去除NO
第一步:NO在碱性环境中被Na2S2O8氧化为NaNO2
第二步:NaNO2继续被氧化为NaNO3,反应为![]() +
+![]() +2OH-
+2OH-![]()
![]() +2
+2![]() +H2O。
+H2O。
不同温度下,平衡时![]() 的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
的脱除率与过硫酸钠(Na2S2O8)初始浓度(指第二步反应的初始浓度)的关系如图所示。
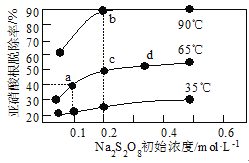
①a、b、c、d四点平衡常数K由大到小的顺序为__,原因是__。
②若a点(0.1,40%)时,![]() 的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
的初始浓度为amol·L-1,平衡时pH=13,则65℃时,第二步反应的平衡常数K=__。(用含a的代数式表示,已知65℃时Kw=1.0×10-13)
(4)利用新型材料光催化脱除NO法如图所示。
某电化学小组将过程A、B设计成酸性电解池反应,则该反应中阴极反应方程式为___。
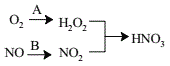
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)若电解食盐水时消耗NaCl的质量为234 g,则在理论上最多可得氯气的体积为________升(标准状况)。
(2)若将2 mol的氯气通入足量石灰乳中,理论上可得到次氯酸钙________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.实验室可用![]() 与浓盐酸在加热条件下制得
与浓盐酸在加热条件下制得![]()
B.![]() 溶液经过蒸发结晶转化为
溶液经过蒸发结晶转化为![]() ,再直接加热脱水即可得
,再直接加热脱水即可得![]()
C.铝热反应可用于焊接铁轨、冶炼难熔金属
D.硝酸分别与甲苯、甘油在合适的条件下反应,均可制得炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA
B.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
C.2.0gD2O中含有的质子数、电子数均为NA
D.含1molCl+的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH![]() 数为NA
数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示两套实验装置,分别回答下列问题。
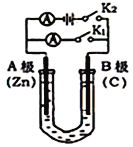
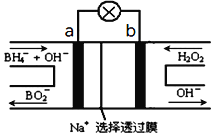
图1 图2
(1)如图1所示,U形管内盛有100mL的溶液,
①打开K2,闭合K1,若所盛溶液为CuSO4溶液:则B极的电极反应式为_______________________。
②打开K1,闭合K2,若所盛溶液为MgCl2溶液,则可观察到的现象是_________________________,总反应化学方程式是_________________________________。
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Ni2+浓度_____(填“增大”、“减小”、“不变”)。
(2)图2装置为硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。
①电池的负极反应式为__________________________
②放电时,每转移2mol电子,理论上需要消耗_________g NaBH4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com