
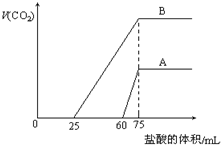
 取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:
取来两份等浓度的NaOH溶液A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,试回答下列问题:分析 (1)先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
(2)当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质;根据发生反应的离子方程式计算出氢氧化钠和碳酸钠的物质的量之比;
(3)先确定B溶液中的溶质,再根据碳酸氢钠和盐酸的反应方程式计算生成二氧化碳的体积.
解答 解:(1)先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,
设氢氧化钠的物质的量浓度为cmol/L,则:0.01L×cmol/L=0.2mol/L×0.075L,解得:c=1.5,即:加入的氢氧化钠溶液的浓度为1.5mol/L,
故答案为:1.5;
(2)当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积远远大于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是NaOH和Na2CO3,其中发生反应HCO3-+H+=H2O+CO2↑消耗的盐酸体积为75mL-60mL=15mL,则发生反应CO32-+H+=HCO3-消耗盐酸体积为15mL,根据图象可知碳酸钠和氢氧化钠溶液总共消耗盐酸60mL,则NaOH溶液完全反应消耗盐酸的体积为:60mL-15mL=45mL,所以NaOH和碳酸钠的物质的量之比为:45:15=3:1,
故答案为:NaOH和Na2CO3;3:1;
(3)当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积小于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是Na2CO3和NaHCO3,碳酸钠和盐酸反应生成碳酸氢钠,有气体生成的化学反应方程式为:HCO3-+H+=H2O+CO2↑,所以当盐酸的为25mL时有二氧化碳生成,即发生的化学反应为:HCO3-+H+=H2O+CO2↑,设生成气体的体积为V,
HCO3-+H+=H2O+CO2↑
1mol 22.4L
0.2(0.075-0.025)mol V
V=$\frac{22.4L×0.2(0.075-0.025)mol}{1mol}$=0.224L=224mL,
故答案为:224.
点评 本题考查混合物反应的计算,题目难度较大,本题关键是根据图象判断溶液溶质的成分,结合离子方程式利用守恒定律计算,明确发生反应的实质为解答关键,试题培养了学生的分析能力及化学计算能力.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
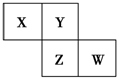 X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中的相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 四种元素的简单氢化物都为极性分子 | |
| B. | 最高价氧化物对应的水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 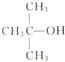 、CH3OH和浓硫酸共热 、CH3OH和浓硫酸共热 | B. | 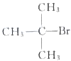 和CH3ONa共热 和CH3ONa共热 | ||
| C. | CH3Br和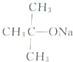 共热 共热 | D. |  和CH3OH在Al2O3存在下共热 和CH3OH在Al2O3存在下共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com