

���� ��1������������Ҫ�����������ơ�þ�Ͻ�Ϊ���������������ܺ���ˣ��ܽ��������ȥ�����
��2���ٲⶨNa2CO3��Һ��pH��������պȡ��Һ����pH��ֽ�ϲⶨ��
�ڼ���ʳ����Һ�Ʊ�NaCl���壬�������������ֲ����ȹ���ɽ���
������O.1mol/L��H2SO4��Һ�������������ã�
����KI������ֽ������Һ�����������ӣ�������պȡ��Һ����KI������ֽ�ϲⶨ��
������10%��KNO3��Һ����������������ܽ⣻
��3����������������������Ϊ�����ӣ����ݵ���غ��ԭ���غ㣬����Na2CO3��Һ��pH��4.0〜4.5���ٽ�������ˮ���γ��������������������ơ�����þ������ˮ��
��4����������NiC2O4•2H2O�����ȿ����и�����ˮ������NiC2O4��NiC2O4�ٷ���������ԭ��Ӧ��Ni��+2�����ߵ�+3�ۣ���C��+3�۽��͵�+2�ۣ�����Ҫ�����ɻ�����壬����һ����ΪCO2������Ni2O3��CO��CO2�������û��ϼ����������ƽ��
��5��Cl��+1�۽��͵�-1�ۣ�Ni��+2�����ߵ�+3�ۣ����û��ϼ�������ȿ���ƽClO-��Ni��OH��2��Cl-��Ni2O3��ϵ����������Hԭ���غ���ƽˮ��ϵ������������Oԭ�Ӽ����ƽ�Ƿ���ȷ�����ݻ�ѧ����ʽ��Ԫ���غ����õ���
��6����Al��NiO��OH��Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱNiO��OH��ת��ΪNi��OH��2��������ԭ��Ӧ����Al����������Ӧ�����������µõ�NaAlO2����ƽ��д����ʽ��
��� �⣺��1��������ͼ�������ܡ����ɺ����������ơ�þ���ӵ���Һ�������ܽ⣬�ܽ��������ȥ��������ˣ�
�ʴ�Ϊ�������ܽ⣬���ˣ�
��2������KI������ֽ���� ��Һ�����������ӣ�������պȡ��Һ����KI������ֽ�ϲⶨ��
�ڼ���ʳ����Һ�Ʊ�NaCl���壬�������������ֲ����ȹ���ɽ���
������O.1mol/L��H2SO4��Һ�������������ã�
�ܲⶨNa2CO3��Һ��pH��������պȡ��Һ����pH��ֽ�ϲⶨ��
������10%��KNO3��Һ����������������ܽ⣻
���Ԣڢݺ͢٢ܷ��ϣ�
�ʴ�Ϊ��bc��
��3����˫��ˮ��Ŀ������������Fe3+����Ӧ�����ӷ���ʽΪ��2Fe2++H2O2+2H+�T2Fe3++2H2O������̼������Һ�������ǵ���pH���ٽ�������ˮ�������ȫ���ټ���NH4F��Ŀ���dz�ȥ�����ӡ�þ���ӣ������Ӳ���ʱ���ɲ�����������
�ʴ�Ϊ��2Fe2++H2O2+2H+�T2Fe3++2H2O���ٽ�������ˮ�������ȫ��Ca2+��Mg2+��
��4����������NiC2O4•2H2O�����ȿ����и�����ˮ������NiC2O4��NiC2O4�ٷ���������ԭ��Ӧ��Ni��+2�����ߵ�+3�ۣ���C��+3�۽��͵�+2�ۣ�����Ҫ�����ɻ�����壬����һ����ΪCO2������Ni2O3��CO��CO2�������û��ϼ�������ȣ�Ni������2����3-2����C������1����4-3����C�����ͣ�3����3-2������ƽ����ʽΪ��2NiC2O4$\frac{\underline{\;����\;}}{\;}$Ni2O3+3CO��+CO2����
�ʴ�Ϊ��2NiC2O4$\frac{\underline{\;����\;}}{\;}$Ni2O3+3CO��+CO2����
��5��Cl��+1�۽��͵�-1�ۣ�Ni��+2�����ߵ�+3�ۣ����û��ϼ�������ȿ���ƽClO-��Ni��OH��2��Cl-��Ni2O3��ϵ����������Hԭ���غ���ƽˮ��ϵ������������Oԭ�Ӽ����ƽ�Ƿ���ȷ���õ����ӷ���ʽΪ��ClO-+2Ni��OH��2�TCl-+Ni2O3+2H2O��
ClO-+2Ni��OH��2�TCl-+Ni2O3+2H2O
1 2
n��ClO-�� a mol
��n��ClO-��=0.5 a mol
Cl2+2OH-�TClO-+Cl-+H2O
0.8n��Cl2�� 0.5 a mol
��n��Cl2��=0.625 a mol
���е��ʱ��
2Cl--2e-�TCl2��
2 1
n��e-�� 0.625 a mol
��n��e-��=1.25a mol��
�ʴ𰸣�ClO-+2Ni��OH��2�TCl-+Ni2O3+2H2O��1.25a mol��
��6����Al��NiO��OH��Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱNiO��OH��ת��ΪNi��OH��2��������ԭ��Ӧ����Al����������Ӧ�����������µõ�NaAlO2���õ�ط�Ӧ�Ļ�ѧ����ʽ�ǣ�Al+3NiO��OH��+NaOH+H2O=3Ni��OH��2+NaAlO2��
�ʴ�Ϊ��Al+3NiO��OH��+NaOH+H2O=3Ni��OH��2+NaAlO2��
���� ���⿼�������̷����ƶϣ�ʵ���������ķ����жϣ���ѧ����ʽ����͵��ԭ������Ӧ�ã���Ŀ�ۺ��Խϴ��ѶȽϴ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ�߶���10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪ij���淴Ӧm A(g)+n B(g) 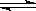 p C(g) ��H�����ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��t ʱ�¶�T��ѹǿP�뷴Ӧ��B�ڻ�������еİٷֺ���B%�Ĺ�ϵ���ߣ������߷����������ж���ȷ����( )
p C(g) ��H�����ܱ������н��У���ͼ��ʾ�ڲ�ͬ��Ӧʱ��t ʱ�¶�T��ѹǿP�뷴Ӧ��B�ڻ�������еİٷֺ���B%�Ĺ�ϵ���ߣ������߷����������ж���ȷ����( )
A��T 1��T2��P1��P2��m+n��p����H��0
1��T2��P1��P2��m+n��p����H��0
B��T1��T2��P1��P2��m+n��p����H��0
C��T1��T2��P1��P2��m+n��p����H��0
D��T1��T2��P1��P2��m+n��p����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶����¿�һ��ѧ���������棩 ���ͣ�ѡ����
��֪H��H����Ϊ436 KJ/mol��H��N����Ϊ391KJ/mol�����ݻ�ѧ����ʽ��N2 ��g��+ 3 H2 ��g�� �� 2 NH3��g�� ��H = - 92.4 KJ/mol����N�� N���� �� �� ��
A��431 KJ/mol B��946 KJ/mol C��649 KJ/mol D��869 KJ/mol
�鿴�𰸺ͽ���>>
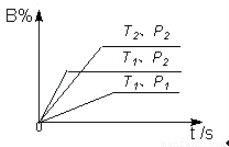
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
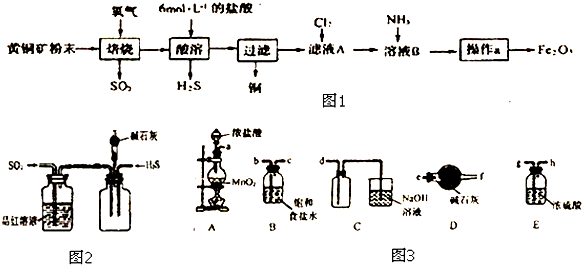
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | 40��֮ǰ��40��֮����Һ������ʱ�����¶ȵı仯�����෴ | |
| B�� | ͼ��b��c�����Ӧ��NaHSO3�ķ�Ӧ������� | |
| C�� | ͼ��a���Ӧ��NaHSO3�ķ�Ӧ����Ϊ5.0��10-5 mol•��L•s��-1 | |
| D�� | �¶ȸ���40��ʱ�����۲���������ʵ���ָʾ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe2O3 | B�� | V2O5 | C�� | MnO2 | D�� | Cr2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | HCl��H2SO4�зų�H2��������ͬ | |
| B�� | CH3COOH�зų�H2��������� | |
| C�� | H2SO4�зų�H2��������죬CH3COOH�зų�H2���������� | |
| D�� | H2SO4�зų�H2������࣬�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2=CH-CI | B�� | CH2=CH-CH=CH2 | C�� | CH3-CH=CH2 | D�� | 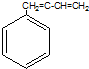 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com