
下列有关化学用语使用正确的是
A.氯原子的结构示意图:
B.CO2分子的比例模型:
C.具有10个中子的氧原子:
D.乙烯的结构简式:C2 H4
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:填空题
(15分)CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H= +180.5kJ/mol ①
C(s)+O2(g)=CO2(g) △H= -393.5kJ/mol ②
2C(s)+O2=2CO(g) △H= -221kJ/mol ③
则 2NO(g) + 2CO(g) N2(g) + 2CO2(g)△H= 。
N2(g) + 2CO2(g)△H= 。
(2)-定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)。
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 (填序号)。
A.增加CO的量 B.加入催化剂
C.降低温度 D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图所示,
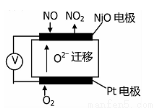
则:
①Pt电极上发生的是 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列实验结论正确的是
A.向某溶液中加入稀盐酸,产生的气体通人澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定不含K+
C.将某气体通人溴水中,溴水颜色褪去,该气体一定是SO2
D.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是

A.分馏产品是纯净物 B.①主要发生物理变化
C.②是石油的裂化 D.③属于取代反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:填空题
(15分)有X、Y、Z三种元素,已知X、Y是元素周期表前20号元素,且X的原子序数比Y大4,元素Z形成的金属单质在日常生活中应用最广泛。请回答:
Ⅰ.若X是短周期最活泼的金属元素。
(1)写出Y的单质的结构式 。
(2)写出单质Z与元素Y的最高价氧化物对应的水化物(稀溶液,过量)反应的离子方程式 。
Ⅱ.若X的简单离子半径是第三周期元素简单离子半径最小的。
(3)在定向爆破中,常利用氧化铁和单质X反应放出的热量来切割钢筋。该反应的化学方程式为 。
(4)已知X的阳极氧化是一种常用的金属表面处理技术,它能使X的表面形成致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中模拟该处理过程,装置如图所示,该阳极的电极反应式为 。

Ⅲ.含Z的化合物A(化学式为K2ZO4)极易溶于水,但静置一段时间后转化为红褐色沉淀,同时产生O2。
(5)化合物A溶于水后的变化 (用离子方程式表示)。查阅资料发现,加入下列物质中的 可提高A在水中的稳定性。
A.Na2CO3 B.KSCN C.NH4NO3 D.KOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
B.将少量Cl2通入FeI2溶液中:2Fe2++Cl2===2Cl-+2Fe3+
C.将大理石投入到足量盐酸中:CO32-+2H+===CO2↑+H2O
D.Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市高三上学期期末化学试卷(解析版) 题型:填空题
(9分)4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:

(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省咸宁市高二上学期期末考试化学(B)试卷(解析版) 题型:填空题
(14分)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是 。
(2)利用配制的CuSO4溶液及如图所示装置,进行以下实验探究。


①图一是根据反应Zn+CuSO4 Cu+ZnSO4设计成的锌铜原电池。甲池中的电解质溶液为 (填化学式)______________,Cu极的电极反应式是__________________,盐桥中是含有琼胶的KCl饱和溶液,电 池工作时Cl-向________(填“甲”或“乙”)池移动。
②图二中,Ⅰ是氢气燃料电池(电解质溶液为KOH溶液)的结构示意图,电池总反应为:2H2+O2=2H2O。该同学想在Ⅱ中实现铁上镀铜,则a处加入的是________(填“H2”或“O2”),b处电极上发生的电极反应式是_____________________。
③若把图二Ⅱ中电极均换为惰性电极且CuSO4溶液足量,电解时的化学反应方程式为 ,
一段时间后,反应停止。下列物质能使Ⅱ池恢复到反应前浓度的是________(填选项字母)。
A.Cu B.CuO C.CuCO3 D.Cu(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com