
| A. | 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则向含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol | |
| D. | 保持其它条件不变,如升高温度,D的体积分数增大,说明该反应的△H<0 |
分析 A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.2倍,可知增大压强,平衡逆向移动;
B.若平衡时,A、B的转化率相等,则起始物质的量之比等于化学计量数之比;
C.若m+n=p+q,可知反应前后气体的物质的量不变;
D.升高温度,D的体积分数增大,说明升温后平衡向着正向移动,则该反应为吸热反应.
解答 解:A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.2倍,可知增大压强,平衡逆向移动,逆反应为气体体积增大的反应,则m+n<p+q,故A正确;
B.若平衡时,A、B的转化率相等,则起始物质的量之比等于化学计量数之比,则说明反应开始时,A、B的物质的量之比为m:n,故B正确;
C.若m+n=p+q,可知反应前后气体的物质的量不变,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a,故C正确;
D.保持其它条件不变,如升高温度,D的体积分数增大,说明升温后平衡向着正向移动,则正反应为吸热反应,其该反应的△H>0,故D错误;
故选D.
点评 本题考查化学平衡的移动、化学平衡及其影响,为高频考点,题目难度中等,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意气体的化学计量数的关系.


科目:高中化学 来源: 题型:选择题
| A. | ①>②>③ | B. | ③>②>① | C. | ②>③>① | D. | ③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
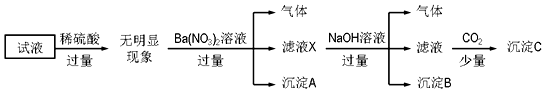
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| C. | 沉淀C为Al(OH)3 | |
| D. | 无法确定原试液中是否含有K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
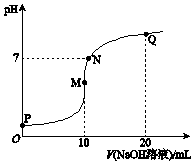 25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )
25℃时,向10mL 0.1mol•L-1 NH4HSO4溶液中逐滴滴入0.1mol•L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如图所示.下列选项正确的是( )| A. | P点pH较低的主要原因是NH4+水解 | |
| B. | P、M、N、Q四点中,水的电离程度较大的是N点 | |
| C. | M点 c(Na+)>c(NH4+); N点 c(NH4+)+c(Na+)═2c(SO42-) | |
| D. | Q点 c(NH4+)+c(NH3•H2O)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
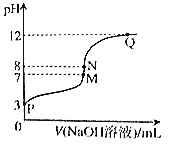 T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )
T℃时,在20.00mL0.10mol•L-1CH3COOH溶液中滴入0.10mol•L-1NaOH溶液,溶液pH与NaOH溶液体积关系关系如图所示.下列说法正确的是( )| A. | T℃时,CH3COOH电离平衡常数Ka=1.0×10-3 | |
| B. | M点对应的NaOH溶液体积为20.00mL | |
| C. | N点与Q点所示溶液中水的电离程度:N>Q | |
| D. | N点所示溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
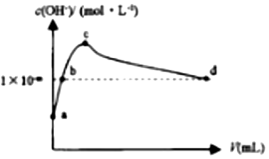 常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )
常温下,向1LpH=10的NaOH溶液中持续通入CO2.通入CO2的体积(V)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述不正确的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-mmol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
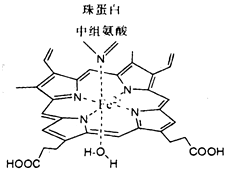 红细胞中血红素结构如图所示,回答下列问题:
红细胞中血红素结构如图所示,回答下列问题: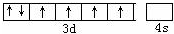 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com