
| A、丁达尔效应可以用于区别FeCl3溶液和Fe(OH)3胶体 |
| B、加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体.溶液中一定含有大量的NH4?+ |
| C、加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO3 2- |
| D、先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:

| A、Bi元素的质量数是209.0 |
| B、Bi元素中子数为83 |
| C、Bi原子6p亚层有有一个未成对电子 |
| D、Bi位于第六周期VA族,属于p区 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 固体样品的剩余质量 |
| 固体样品的起始质量 |
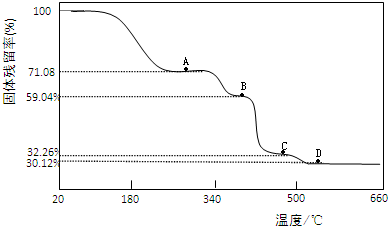
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
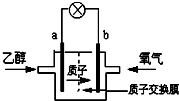 美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图.下列说法不正确的是( )
美国圣路易斯大学科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2→2CO2+3H2O,电池示意如图.下列说法不正确的是( )| A、a极为电池的负极 |
| B、电池工作时电流由b极沿导线经灯泡再到a极 |
| C、电池正极的电极反应为:4H++O2+4e-=2H2O |
| D、1mol乙醇被氧化,电路中转移6NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
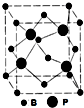 磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3?BCl3制得.
磷化硼是一种高折射率红棕色晶体,可通过单质B与Zn3P2(或PH3)反应,也可热解PCl3?BCl3制得.查看答案和解析>>
科目:高中化学 来源: 题型:
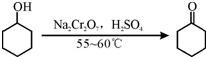 其反应的装置示意图如图1(夹持装置、加热装置略去):
其反应的装置示意图如图1(夹持装置、加热装置略去):
| 物质 | 沸点(℃) | 密度(g?cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.3301 | |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com