
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
分析 (1)向0.1mol•L-1CH3COOH 溶液中加入少量CH3COONa 晶体时,会抑制醋酸的电离,导致酸性减弱,但由于醋酸钠的电离,溶液中总离子浓度增大,Kw只受温度影响;
(2)混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$.$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{(C{H}_{3}COOH)}}{c({H}^{+})}$;
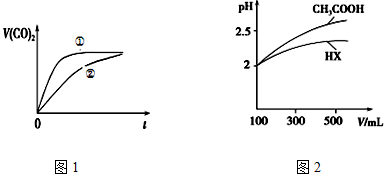
(3)亚硝酸电离平衡常数大于醋酸,所以相同浓度的醋酸和亚硝酸中,亚硝酸中氢离子浓度大于醋酸,所以亚硝酸反应速率大于醋酸,制取相同体积的二氧化碳,亚硝酸需要的时间短;反应结束后,醋酸根离子水解程度大于亚硝酸根离子,根据酸根离子水解程度判断溶液中酸根离子浓度;
(4)pH相同的一元弱酸,加水稀释促进弱酸电离,加水稀释相同的倍数时pH变化越小的酸越弱;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,二者恰好完全反应生成醋酸铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相同.
解答 解:(1)向0.1mol•L-1CH3COOH 溶液中加入少量CH3COONa 晶体时,
a.醋酸钠电离生成的醋酸根离子抑制醋酸电离,所以溶液的酸性减弱,pH增大,故a正确;
b.醋酸钠电离出醋酸根离子导致溶液中醋酸根离子浓度增大,则抑制醋酸电离,所以CH3COOH的电离程度减小,故b错误;
c.醋酸钠是强电解质,完全电离,所以溶液中离子浓度增大,则溶液的导电能力增强,故c错误;
d.溶液中c(OH-).c(H+)=Kw,Kw只受温度影响,温度不变所以Kw不变,故d正确;
故答案为:ad;
(2)混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$.$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{(C{H}_{3}COOH)}}{c({H}^{+})}$=$\frac{1.8×1{0}^{-5}}{1{0}^{-6}}$=18,
故答案为:18;
(3)亚硝酸电离平衡常数大于醋酸,所以相同浓度的醋酸和亚硝酸中,亚硝酸中氢离子浓度大于醋酸,所以亚硝酸反应速率大于醋酸,制取相同体积的二氧化碳,亚硝酸需要的时间短,所以②是醋酸反应曲线;反应结束后,醋酸根离子水解程度大于亚硝酸根离子,所以溶液中存在c(CH3COO-)<c(NO2-);
故答案为:②;<;
(4)pH相同的一元弱酸,加水稀释促进弱酸电离,加水稀释相同的倍数时pH变化越小的酸越弱,根据图知,稀释相同的倍数时HXpH变化小于醋酸,所以HX酸性小于醋酸,则HX的电离平衡常数小于CH3COOH的电离平衡常数,故答案为:小于;
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,二者恰好完全反应生成醋酸铵,溶液的pH=7,说明醋酸根离子和铵根离子水解程度相同,则醋酸电离平衡常数等于一水合氨电离平衡常数为1.8×10-5,故答案为:1.8×10-5.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质电离平衡常数与电解质强弱关系是解本题关键,酸的电离平衡常数越大其电离程度越大,则其酸根离子水解程度越小,注意(2)题分式的灵活变换,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | a、b两点溶液中水的电离程度相同 | |
| B. | a、b两点溶液的pH满足:pH(a)>pH(b) | |
| C. | c点溶液满足:c(Na+)>c(CO3 2-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO3 2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:7 | B. | 5:7 | C. | 7:8 | D. | 7:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+) | |
| B. | Ka1(H2CO3)•Ka2(H2CO3)<KW | |
| C. | c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008 mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol•L-1) | |
| D. | 若将0.001 mol•L-1 AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤④①② | B. | ③④②①⑤ | C. | ④①②⑤③ | D. | ③②④①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+OH-?CH3COO-+H2O | B. | HCO3-+H2O?CO32-+H3O+ | ||
| C. | S2-+H2O?HS-+OH- | D. | NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com