
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
分析 (1)氯化铁具有氧化性、硫化氢具有还原性,二者发生氧化还原反应生成亚铁离子和S;
(2)铁离子和KSCN发生络合反应生成络合物;
(3)Cl-在阳极放电(或Cl-失电子生成Cl2),生成的Cl2具有氧化性,能氧化还原性离子;
(4)失电子作还原剂的物质具有还原性;
(5)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断;
②氯气能使湿润的淀粉碘化钾试纸变蓝色;
③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,生成铁离子的两种可能.
解答 解:(1)氯化铁具有氧化性、硫化氢具有还原性,二者发生氧化还原反应生成亚铁离子和S,离子方程式为2Fe3++H2S═S↓+2Fe2++2H+,故答案为:2Fe3++H2S═S↓+2Fe2++2H+;
(2)铁离子和KSCN发生络合反应生成络合物硫氰化铁而使溶液呈血红色,离子方程式为Fe3++3SCN-═Fe(SCN)3,故答案为:Fe3++3SCN-═Fe(SCN)3;
(3)Cl-在阳极放电(或Cl-失电子生成Cl2),生成的Cl2将Fe2+氧化生成铁离子,故答案为:Cl-在阳极放电(或Cl-失电子生成Cl2),生成的Cl2将Fe2+氧化;
(4)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,故答案为:还原;
(5)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2;
②氯气能使湿润的淀粉碘化钾试纸变蓝色,如果试纸变蓝色证明生成氯气,否则无氯气生成,
故答案为:湿润的淀粉碘化钾检验生成气体,试纸变蓝;
③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,说明生成铁离子的两种可能,一是二价铁失电子变成三价铁,二是氯离子失电子变成氯气,氯气再氧化二价铁变成三价铁.对于补充的那个实验,实验四的电压高,氯气放电,实验五电压低,氯气不放电,而实验二氯气皆放电;
故答案为:通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl-放电.
点评 本题考查电解原理,为高频考点,涉及氧化还原反应、电解原理、离子检验等知识点,明确化学反应原理及物质性质是解本题关键,知道铁离子、氯气的检验方法及现象,熟练掌握离子放电顺序,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烷与Cl2取代 | B. | 乙烯与Cl2加成 | ||
| C. | 乙炔与HCl加成 | D. | 乙醇与浓盐酸取代 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
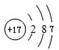 ,D微粒的结构示意图是
,D微粒的结构示意图是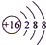 ,写出E的三种核素11H、21H、31H.
,写出E的三种核素11H、21H、31H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | F | |||
| 3 | G | H | I | J | K | L | M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
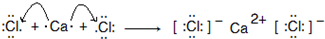 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O比Na2O2稳定 | B. | 均不可与水反应 | ||
| C. | 均可与CO2反应 | D. | 均是典型的碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
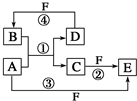 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).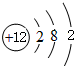 ,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ③⑥⑦ | C. | ③⑥⑦⑧ | D. | ②④⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com