
| A. | Na2SO4 | B. | KCl | C. | NaOH | D. | CuSO4 |
分析 根据离子的放电顺序判断电解实质,根据电解实质判断溶液中氢离子浓度与氢氧根离子浓度的关系结合题意判断选项.
解答 解:A、电解硫酸钠溶液时,实际上电解的是水,所以溶液的pH值不变,仍为7,故A不符合;
B、电解KCl溶液时,阴极上析出氢气,阳极上得到氯气,所以溶液中的氢氧根离子浓度增大,溶液的pH值增大,溶液的pH>a,故B不符合;
C、电解氢氧化钠溶液时,实际上电解的是水,但溶液中的氢氧根离子的浓度增大,氢离子的浓度减小,所以溶液的pH值增大,故C不符合;
D、电解硫酸铜溶液,产物是金属铜、水和硫酸,有硫酸铜到电解后的硫酸溶液,pH减小,故D符合;
故选D.
点评 本题考查了电解原理,随着电解的进行判断溶液pH值的变化,首先要知道离子的放电顺序、电解的实质,只有明白这些知识点才能正确解答,题目难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.3mol/(L•s) | B. | 0.4 mol/(L•s) | C. | 0.6 mol/(L•s) | D. | 0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下某CH3COONa溶液的pH=8 | |
| B. | 用CH3COOH溶液做导电实验,灯泡很暗 | |
| C. | 等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 | |
| D. | CH3COONa和H3PO4反应,生成CH3COOH. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -16Q kJ/mol | B. | +8Q kJ/mol | C. | +16 Q kJ/mol | D. | -8 Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 判据△H-T△S适合任何条件下的反应 | |
| B. | 放热反应在室温下不一定自发进行 | |
| C. | 自发反应一定是熵增大,非自发反应一定是熵减少或不变 | |
| D. | 如果△H和△S均为正值,当温度升高时,反应可能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究性学习小组进行CH4的性质探究实验.
研究性学习小组进行CH4的性质探究实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 如图表示H2与O2发生反应过程中的能量变化,H2的燃烧热为571.6 kJ•mol-1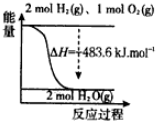 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com