
| A. | 浓度为0.1mol/L | B. | 浓度为1mol/L | C. | 含NaOH 4g | D. | 含NaOH 0.1mol |
分析 由于溶液是均匀的,从2L 1mol/L NaOH溶液中取出100ml溶液,这100ml氢氧化钠溶液与剩余的900mL氢氧化钠溶液的浓度相同,与原2L 1mol/L NaOH溶液浓度相同.
A、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原1L 1mol/L NaOH溶液浓度相同;
B、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原1L 1mol/L NaOH溶液浓度相同;
C、根据m=cVM计算100ml溶液中氢氧化钠的质量.
D、根据n=cV计算100ml溶液中氢氧化钠的物质的量.
解答 解:由于溶液是均匀的,从2L 1mol/L NaOH溶液中取出100ml溶液,这100ml氢氧化钠溶液与原2L 1mol/L NaOH溶液浓度相同为1mol/L.
A、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原2L 1mol/L NaOH溶液浓度相同为1mol/L,故A错误;
B、由于溶液是均匀的,取出的100ml氢氧化钠溶液与原1L 1mol/L NaOH溶液浓度相同为1mol/L,故B正确;
C、取出的100ml氢氧化钠溶液中氢氧化钠的质量为0.1L×1mol/L×40g/mol=4g,故C正确;
D、取出的100ml氢氧化钠溶液中氢氧化钠的物质的量为0.1L×1mol/L=0.1mol,故D正确;
故选A.
点评 本题考查学生对物质的量浓度的理解与常用化学计量的有关计算,比较基础,注意基础知识的理解掌握,题目难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
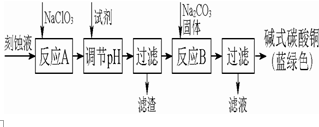 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | |
| C. | 分离FeCl3、KCl、BaSO4的固体混合物,应采用的一组试剂是:水、氢氧化钠、盐酸 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂与氧化产物的物质的量之比为5:8 | |
| B. | 若氧化产物比还原产物多1.4mol则转移电子为1mol | |
| C. | 每生成1.6mol氮气,则有0.2molKNO3被氧化 | |
| D. | NaN3属于硝酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是铁合金,钢的含碳量低于生铁,性能优于生铁 | |
| B. | 金属具有的物理通性是延展性、导热性、银白色光泽、导电性 | |
| C. | 符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质 | |
| D. | 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120℃,将wg甲醛在足量空气中燃烧,将生成产物用固体Na2O2(过量)吸收,固体增重wg | |
| B. | 24gMg带在足量CO2气体中燃烧,生成固体质量为40g | |
| C. | 相同物质的量的Al、Al2O3、Al(OH)3与足量NaOH溶液反应,溶液增重相等 | |
| D. | 在Fe3O4与足量浓硝酸的反应中,参加反应的Fe3O4与体现酸性的HNO3物质的量之比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
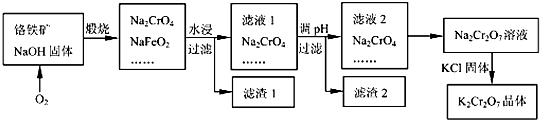
 Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.
Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com