
| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下,pH=12的氨水与pH=2的盐酸等体积混合溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | 25℃时,0.1 mol•L-1pH=4.5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-) | |
| D. | 常温下,等浓度的CH3COONa和CH3COOH混合溶液:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
分析 A.常温下,Na2CO3、HCl的物质的量之比为5:4,则Na2CO3和HCl以1:1反应且Na2CO3有剩余,溶液中溶质为Na2CO3、NaCl、NaHCO3,且物质的量之比为1:4:4,任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.常温下,pH=12的氨水浓度大于0.01mol/L,pH=2的盐酸浓度为0.01mol/L,二者等体积混合,氨水有剩余,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,但电离和水解程度都较小,结合电荷守恒判断;
C.25℃时,0.1 mol•L-1的NaHSO3溶液pH=4.5,溶液呈酸性,说明HSO3-电离程度大于水解程度;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.常温下,Na2CO3、HCl的物质的量之比为5:4,则Na2CO3和HCl以1:1反应且Na2CO3有剩余,溶液中溶质为Na2CO3、NaCl、NaHCO3,且物质的量之比为1:4:4,任何电解质溶液中都存在物料守恒,根据物料守恒得5c(Cl-)=4c(HCO3-)+4c(CO32-)+4c(H2CO3),故A正确;
B.常温下,pH=12的氨水浓度大于0.01mol/L,pH=2的盐酸浓度为0.01mol/L,二者等体积混合,氨水有剩余,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,但电离和水解程度都较小,结合电荷守恒得c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B正确;
C.25℃时,0.1 mol•L-1的NaHSO3溶液pH=4.5,溶液呈酸性,说明HSO3-电离程度大于水解程度,则存在c(HSO3-)>c(SO32-)>c(H2SO3),故C错误;
D.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
根据物料守恒得2c(Na+)=c(CH3COO-)-c(CH3COOH),所以得c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)],故D正确;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,正确判断混合溶液中溶质及其性质、弱酸氢根离子水解和电离程度相对大小是解本题关键,电荷守恒和物料守恒与溶液中溶质种类多少无关,易错选项是A,注意:碳酸钠和稀盐酸反应不生成二氧化碳.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
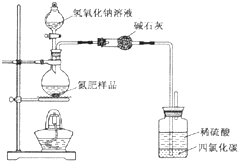 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
样品质量/g | 7.750 | 15.50 | 23.25 |
氨气质量/g | 1.870 | 1.870 | 1.700 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
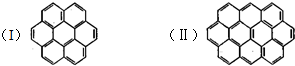 有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:
有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
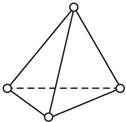 (1)根据要求填空:
(1)根据要求填空:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
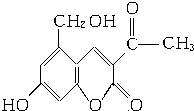 它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.
硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.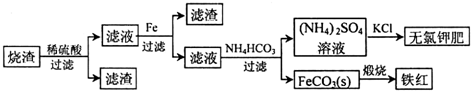

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4含有4nA个Cl原子 | |
| B. | 7.8 g Na2O2与足量水反应转移0.2nA个电子 | |
| C. | 0.1 mol•L-1NaCl溶液中含有0.1nA个Na+ | |
| D. | 常温常压下,23 gNO2、N2O4混合气体中含有nA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com