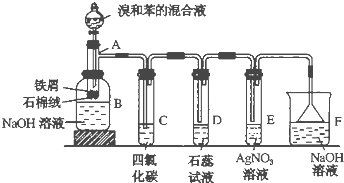
在50mL a mol?L
-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO
2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO
3-)=3mol?L
-1.
(1)求稀释后的溶液的pH=
.
(2)若生成的气体中NO
2的物质的量为0.125mol,则a=
.
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO
2+NO+2NaOH→2NaNO
2+H
2O 2NO
2+2NaOH→NaNO
2+NaNO
3+H
2O
若将上述(2)中的NO
2和NO的混合气体通入2mol?L
-1的NaOH恰好被吸收,求NaOH溶液的体积为
mL.生成的NaNO
2为
mol.
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理.其主要反应原理如下:
4NO+4NH
3+O
24N
2+6H
2O 6NO
2+8NH
37N
2+12H
2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m
3(体积已折算至标准状况),其中NO与NO
2物质的量比为4:1.设尾气中氮氧化物与氨氧混合气恰好完全反应.
①氨氧混合气的平均相对分子质量为
(精确到0.01).
②要处理5m
3的尾气,需要氨氧混合气的体积为
L.



 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案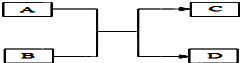 A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.
A、B、C、D是初中化学常见物质,它们之间的转化关系(反应的条件未标出)如图所示.已知A是一种碱,常用于改良酸性土壤,C是最常见溶剂.

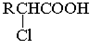 ;RCH2Br
;RCH2Br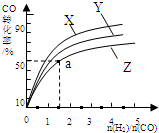 研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.
研究碳氧化物的利用对促进低碳社会的构建具有重要的意义.