
分析 Na、Na2O2的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比;然后分别根据反应方程式计算出钠、过氧化钠的物质的量,再根据m=nM计算出其质量,最后计算出质量之比.
解答 解:Na、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,
该混合气体通过放电,恰好完全反应,根据方程式2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,设氢气为2nmol,则氧气为nmol,所以2nmol×2+32n=0.36g,则n=0.01mol,
根据2Na+2H2O=2NaOH+H2↑可知,钠的物质的量为4nmol,钠的质量为:23g/mol×4nmol=92ng=0.92g;
根据2Na2O2+2H2O=4NaOH+O2↑可知,过氧化钠的物质的量为2nmol,过氧化钠的质量为:2nmol×78g/mol=156ng=1.56g,
(1)混合物中过氧化钠的质量分数是:$\frac{1.56g}{1.56g+0.92g}$×100%=62.9%;
(2)所得溶液的物质的量浓度:c=$\frac{n}{V}$=$\frac{0.04+0.02×2}{0.2}$=0.4mol/L;
答:(1)混合物中过氧化钠的质量分数为:62.9%;
(2)所得溶液的物质的量浓度为:0.4mol/L.
点评 本题考查混合物计算,题目难度中等,确定混合气体中氢气与氧气的物质的量之比为2:1是解答关键,注意掌握钠、过氧化钠与水反应的方程式.


科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,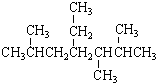 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,邻二甲苯、间二甲苯、对二甲苯的沸点依次增大 | |
| C. | 已知1mol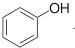 可以与1molNaOH发生反应.则1mol 可以与1molNaOH发生反应.则1mol 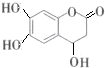 与足量的NaOH溶液发生反应时,需消耗4molNaOH 与足量的NaOH溶液发生反应时,需消耗4molNaOH | |
| D. | 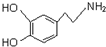 属于氨基酸,既能与强酸反应,又能与强碱反应 属于氨基酸,既能与强酸反应,又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘上升 | B. | 右盘下沉 | C. | 仍保持平衡 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,产生白色沉淀,加入HNO3后,白色沉淀不溶解,也无其他现象,说明原溶液中一定含有SO42- | |
| B. | 向某溶液中加盐酸产生无色无味气体,该气体能使澄清的石灰水变浑浊,说明该溶液中一定含有CO32- | |
| C. | 收集氯气时,用湿润的KI淀粉试纸放置于瓶口,观察试纸是否变蓝判断是否收集满 | |
| D. | 某样品的焰色反应呈黄色,则该样品一定是单质钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
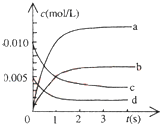 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com