
(12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
(12分)
(1)MnCO3+H2SO4 =MnSO4+ CO2↑+H2O (2分,气体符号不扣分)
(2)抑制Mn2+的水解 (2分)
(3)MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O(2分)
(4)CoS和NiS (每个1分,共2分)
(5)阴(1分) Mn2++2e-=Mn(1分) (6)1×10-6 mol/L (2分)
【解析】
试题分析:(1)碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,所以化学方程式是MnCO3+H2SO4 =MnSO4+ CO2↑+H2O;
(2)根据表中数据可知氢氧化锰是弱碱,所以硫酸锰水解生成氢氧化锰和硫酸,则硫酸过量的第三个作用是抑制锰离子水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,二氧化锰被还原为锰离子,离子方程式是MnO2+2Fe2++4H+ =Mn2++2Fe3++2H2O;
(4)根据流程图可知,除杂1时,将铁离子除去,则除杂2的目的是除去镍离子和钴离子,根据沉淀的溶度积可知,加入硫化铵后,镍离子和钴离子已硫化物的沉淀除去,所以滤渣2的主要成分是CoS和NiS;
(5)电解时,锰离子在阴极发生还原反应,所以Mn在阴极析出;电极反应式是Mn2++2e-=Mn;
(6)因为KMnS=1.0×10-11,所以欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥KMnS/ c(Mn2+)=1×10-6 mol/L。
考点:考查对工业流程的分析,溶度积的应用,离子方程式的书写


科目:高中化学 来源:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列判断正确的是
A.标准状况下,4.48L苯中含有的分子数目为0.2NA
B.1.5 mol L-1 MgCl2溶液中含有的Cl-离子数目为3NA
C.常溫常压下,32gO2和O3的混合气体中含有的氧原子数目为2NA
D.5.6g金属Fe与足量Cl2反应转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省菏泽市高三上学期期末考试化学B试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA。
B.标准状况下,0.1 mol Cl2溶于水,转移电子的数目为0.1 NA。
C.2.3 g Na与O2完全反应生成3.6 g产物时失电子数是0.1×6.02×1023
D.标准状况下,11.2 L CH3CH2OH中含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省德州市高三2月期末统考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.放热反应的反应速率一定大于吸热反应的反应速率
B.熔融状态下能导电的化合物一定含离子键
C.增大反应物浓度可加快反应速率,因此可用浓硫酸与 铁反应增大生成氢气的速率
铁反应增大生成氢气的速率
D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:填空题
(12分)前四周期元素A、B、C、D、E原子序数依次增大,A是周期表所有原子中原子半径最小的,B有三个能级,且各个能级上电子数相等,D与C同周期,且C中未成对电子是该周期中最多的;D基态原子的2p电子是2s电子的2倍;E有4个电子层,且与A最外层电子数相同,其他各层均排满。
(1)写出E2+的基态核外电子排布式 。
(2)A和C可以形成18电子的分子,该分子中C原子的杂化方式为 。
(3)C与D形成的酸根离子CD3-
①CD3-的空间构型为 (用文字描述)。
②写出一种与CD3-互为等电子体的分子的化学式 。
(4)CA3的沸点比BA4的沸点高的原因是 。
(5)E2+与C的常见氢化物形成配位数为4的配合物离子,1mol该离子中含σ键数目为 。
(6)E晶胞结构如图所示,该晶体中每个E原子周围距离最近的E原子数目为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0
B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
C.恒温下,体积可变的密闭容器中发生反应2NO2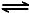 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大
N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大
D.25℃时,将NH3H2O稀溶液加水稀释,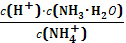 的值不变
的值不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三下学期期初联考化学试卷(解析版) 题型:选择题
下列物质性质与应用对应关系均正确的是
A.SO2具有漂白性,可用SO2加工银耳,使之更白
B.炭具有强还原性,常用于冶炼镁、钠等金属
C.淀粉遇碘变蓝色,常用于检验食盐是否为加碘盐
D.NaHCO3可以与胃酸反应,可用NaHCO3治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省仙桃天门潜江高三上学期期末联考理综化学试卷(解析版) 题型:填空题
【化学——选修5有机化学基础】(15分)
G是一种合成橡胶和树脂的重要原料,A是C、H、O三种元素组成的五元环状化合物,相对分子质量为98,其核磁共振氢谱只有一个峰;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3。已知:(其中R是烃基)

有关物质的转化关系如下图所示,请回答以下问题。

(1)A中不含氧的官能团的名称是 ;⑤的反应类型是 。G的结构简式为 ;G与Br2的CCl4溶液反应,产物有 种(不考虑立体异构)。
(2)反应②的化学方程式为 。
(3)E可在一定条件下通过 (填反应类型)生成高分子化合物,写出该高分子化合物可能的结构简式 (两种即可)。
(4)反应⑥的化学方程式为 。
(5)有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的Y的结构简式 。Y与足量氢氧化钠溶液反应所得产物之一M,能与灼热的氧化铜反应,写出M与灼热的氧化铜反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省肇庆市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列推断合理的是
A.Cu的活动性排在H之后,不能与浓H2SO4发生反应
B.金刚石是自然界中硬度最大的物质,不能氧气发生反应
C.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com