
| A. | v(A)=0.5mol/(L•s) | B. | v(B)=0.2mol/(L•s) | C. | v(C)=0.9mol/(L•s) | D. | v(D)=1mol/(L•s) |
科目:高中化学 来源: 题型:选择题

| A. | 装置A的作用是除去氯气中的水蒸气 | |
| B. | 该实验必须在通风橱中进行 | |
| C. | 装置C中发生的反应为Cl2+2NaOH═NaCl+NaClO+H2O | |
| D. | 装置B的现象是干燥处布条褪色,湿润处布条不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在一定条件下与水反应 | |
| B. | 在光照条件下,甲烷与氯气的反应 | |
| C. | 在一定条件下,苯与氯气的反应 | |
| D. | 乙烯通入溴的四氯化碳溶液中的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀醋酸反应:Zn+2H+=Zn2++H2↑ | |
| B. | 碳酸氢钠溶液加入少量石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | 铜与稀硝酸反应制取一氧化氮:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | 在硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯均能使溴水褪色 | |
| B. | 乙酸和乙酸乙酯均能发生取代反应 | |
| C. | 甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 | |
| D. | 葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
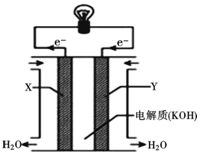 人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | |
| B. | O2和O3的相互转化是物理变化 | |
| C. | 在相同的温度与压强下,等体积的O2和O3含有气体的分子数相同 | |
| D. | 等质量的O2和O3含有相同的质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 选用试剂 | 预期的实验现象 | |
| 甲同学的方案 | ||
| 乙同学的方案 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系:pH(Na2CO3)>pH(CH3COONa)>pH(NaCN) | |
| B. | NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)c+(CO32-)+c(OH-) | |
| C. | 向PH=1的醋酸溶液中加水稀释,醋酸的电离度、pH均先增大后减小 | |
| D. | a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合,若pH=7,则a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com