
| A. | ②⑥ | B. | ②③ | C. | ④⑤ | D. | ①⑥ |
分析 可逆反应2NO2?N2O4,正反应放热,平衡后把该容器置于冰水中,降低了温度,化学平衡向着放热方向进行,所以化学平衡2NO2?N2O4向右进行,
①混合气体总的物质的量减小,总质量不变,根据M=$\frac{m}{n}$判断;
②反应混合物都是气体,根据质量守恒定律判断;
③二氧化氮的浓度减小,颜色变浅;
④降低温度,化学平衡向右移动,混合气体总的物质的量减小,容器的容积不变,根据pV=nRT判断;
⑤反应气体气体的总质量不变,平衡向着正向移动,各组分的质量分数发生变化;
⑥根据ρ=$\frac{m}{V}$进行判断密度的变化情况.
解答 解:可逆反应2NO2?N2O4,正反应放热,平衡后把该容器置于冰水中,降低了温度,化学平衡向着放热方向进行,所以化学平衡2NO2?N2O4向右进行,
①正反应为气体体积缩小的反应,而气体的总质量不变,根据M=$\frac{m}{n}$可知,混合气体的平均相对分子质量增大,故①错误;
②反应混合物都是气体,根据质量守恒定律,混合气体总的质量始终不变,故②正确;
③平衡向着正向移动,二氧化氮的浓度减小,气体颜色变浅,故③错误;
④降低温度,化学平衡向右移动,混合气体总的物质的量减小,容器的容积不变,根据pV=nRT可知,容器内压强减小,故④错误;
⑤反应混合物都是气体,根据质量守恒定律,混合气体总的质量不变,而各组分的质量发生变化,则各组分的质量分数发生变化,故⑤错误;
⑥反应前后都是气体,气体的总质量不变,而容器的容积不变,根据ρ=$\frac{m}{V}$可知,混合气体的密度始终不变,故⑥正确;
综上所述性质或数值不会改变的是②⑥,
故选A.
点评 本题考查了化学平衡的影响因素,题目难度中等,明确温度、压强等因素对化学平衡的影响为解答关键,试题侧重考查学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
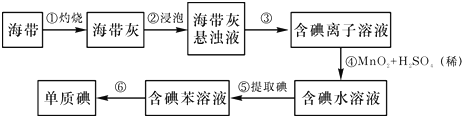
 苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下:
苯甲酸乙酯(C9H10O2)有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,其制备步骤如下: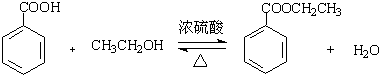 .
.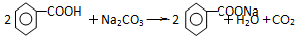 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
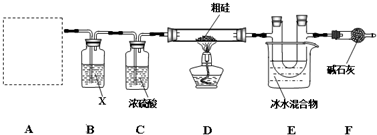
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个C-H键的长度相等 | B. | 4个C-H键的强度相同 | ||
| C. | 4个C-H键的夹角相同 | D. | 4个C-H连接成正方形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
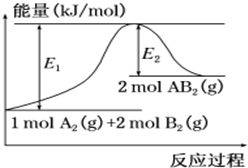 已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2 (g)+2B2 (g)═2AB2(g) (AB2的分子结构为B-A-B)的能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热 | |
| B. | 该反应的△H=-(E1-E2)kJ/mol | |
| C. | 该反应中反应物的键能总和大于生成物的键能总和 | |
| D. | 断裂1 mol A-A和2 mol B-B放出E1 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
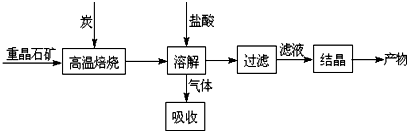
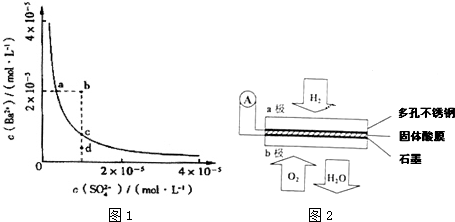
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小容器体积,平衡向右移动 | |
| B. | 加入催化剂,平衡不移动故正逆反应速率不变 | |
| C. | 增大c(X),X的转化率增大 | |
| D. | 降低温度,Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com