
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
A
【解析】
试题分析:A、由表中数据可知反应进行到7min时达到平衡,此时Y的物质的量浓度是0.010mol/L,根据化学方程式可知,X的平衡物质的量浓度也是0.010mol/L,则Z的平衡物质的量浓度是2(0.016-0.010)=0.012mol/L,所以K=0.0122mol/L/0.0102mol/L=1.44,正确;B、该反应是放热反应,所以降低温度,平衡正向移动,再达平衡前,ν(逆)<ν(正),错误;C、反应前2min的平均速率ν(Y)=(0.16-0.12)mol/10L/2min=0.002mol·L-1·min-1,则ν(Z)=2ν(Y)=0.004 mol·L-1·min-1,错误;D、该反应是反应前后气体的物质的量不变的可逆反应,所以气体条件不变,再充入0.2molZ,再达平衡与原平衡是等效平衡,X的体积分数不变,错误,答案选A。
考点:考查化学平衡的移动的判断,平衡常数的计算


科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列有关能量的判断或表示方法正确的是
A.从C(石墨)=C(金刚石) ΔH=1.9 kJ·mol-1,可知金刚石比石墨更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
D.同一个化学反应,化学计量数不同,ΔH的值不同;化学计量数相同而状态不同,ΔH的值也不同。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:填空题
(10分)已知有一种节能的氯碱工业新工艺,将电解池和燃料电池相组合,相关流程如下图所示(电极未标出):回答下列有关问题:
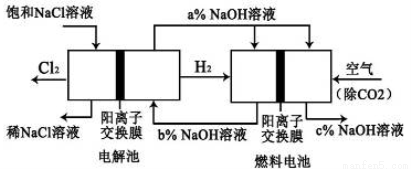
(1)电解池的阴极反应式为 _____________________________________
(2)通入空气的电极为_______________(“正极”或“负极”)
燃料电池中阳离子的移动方向___________(“从左向右”或“从右向左”)。
(3)电解池中产生2 mol Cl2,理论上燃料电池中消耗_____ mol O2。
(4)a、b、c的大小关系为:__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
常温下,分别将四块形状相同,质量为7 g的铁块同时投入下列四种溶液中,生成氢气速率最快的是
A.200 mL 2 mol·L-1HCl B.100 mL 2 mol·L-1H2SO4
C.100 mL 3 mol·L-1HNO3 D.50 mL 18.4 mol·L-1H2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:填空题
(13分)工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可以采取的措施是_____(填字母代号)。
A 高温高压 B 加入催化剂 C 减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 序号 | 温度 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知下列各组反应的反应物及温度,则反应开始时,放出H2的速率最快的是(表中的物质均为反应物)
编号 | 金属(大小、形状相同的粉末)物质的量 | 酸的浓度及体积 | 反应温度/℃ |
A | Mg 0.1 mol | 3 mol/L的硝酸10 mL | 60 |
B | Mg 0.1 mol | 3 mol/L的盐酸10 mL | 30 |
C | Fe 0.1 mol | 3 mol/L的盐酸10 mL | 60 |
D | Mg 0.1 mol | 3 mol/L的盐酸10 mL | 60 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1mol 液溴变Br2(g)需要吸收的能量为30kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为
A.404 B.260 C.230 D.200
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:选择题
一定温度下在一容积不变的密闭容器中发生可逆反应2X(g) Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.2v正(X)=v逆(Y) B.单位时间内生成1 mol Y的同时生成2 mol X
C.混合气体的密度不再变化 D.反应容器中Y的质量分数不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(A)试卷(解析版) 题型:选择题
以下物质中所含分子数最多的是( )
A.4℃时,36 mL H2O B.常温常压下,28g N2
C.含原子总数为15NA的CH4 D.标准状况下,89.6L He
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com