
| A. | KW/C(OH-)=10-12mol•L-1的溶液中:Na+、K+、SiO32-、Cl- | |
| B. | 使甲基橙变黄的溶液中:NH4+、Cu2+、NO3-、SO42- | |
| C. | 由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液中:Na+、CO32-、SO32-、Cl- | |
| D. | 使KSCN显红色的溶液中:NH4+、K+、Cl-、A1O2- |
分析 A.KW/C(OH-)=10-12mol•L-1的溶液,显碱性;
B.使甲基橙变黄的溶液,可能显碱性;
C.由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液,为酸或碱溶液;
D.使KSCN显红色的溶液,含铁离子.
解答 解:A.KW/C(OH-)=10-12mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.使甲基橙变黄的溶液,可能显碱性,不能大量存在NH4+、Cu2+,故B错误;
C.由水电离出的 c(H+ )=1.0×l0-13 mol•L-1的溶液,为酸或碱溶液,酸溶液中不能大量存在CO32-、SO32-,故C错误;
D.使KSCN显红色的溶液,含铁离子,与A1O2-相互促进水解不能共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原溶液一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 若要证明原溶液中是否存在 Cl-,可在第①步的滤液中加硝酸酸化后再加硝酸银溶液 | |
| C. | 加Ba(OH)2溶液中使原溶液中的离子恰好反应且完全沉淀时,混合液呈中性 | |
| D. | 第②步实验中共消耗0.04mol HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
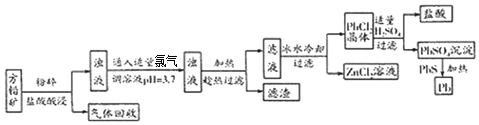
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
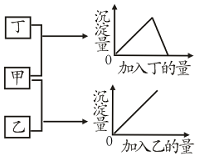 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )| A. | Al2(SO4)3 | B. | NaOH | C. | FeSO4 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | K+ | Na+ | Cu2+ | Al3+ |
| 阴离子 | SO42- | HCO3- | NO3- | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试验操作和现象 | 结论 |
| A | 向浓度均为0.1mol.L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液,溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 室温下,实验测得:0.1mol.L-1Na2CO3溶液的PH约为11.6;0.1mol.L-1NaHCO3溶液的PH约为7.9 | CO32-结合H+的能力比HCO3-的强 |
| D | 某盐酸溶液中滴加盐酸,产生无色无味气体,将气体通入澄清石灰水变浑浊 | 该盐一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ae | B. | aef | C. | abc | D. | ac |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NH3溶于水显碱性 | 用氨气作“喷泉实验” |
| B | 高锰酸钾具有强氧化性 | 高锰酸钾须与活性金属粉末分开储存 |
| C | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| D | 碘在酒精中溶解度大于在水中溶解度 | 用酒精萃取碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com