
1.52g铜镁合金完全溶解于50mL 63%的浓硝酸(硝酸密度为1.40g/mL)中,得到标况下NO2和N2O4 的混合气体1120mL。向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
A.该合金中n(Cu):n(Mg)=2:1
B.合金完全溶解时,溶液中c(H+)=11.8mol/L(忽略反应前后溶液体积变化)
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54g沉淀时,加入NaOH溶液的体积是600 mL
BD
【解析】
试题分析:A.假设在金属混合物中含有Cu、Mg的物质的量分别是x、y,根据题意可得64x+24y=1.52g;98x+58y=2.54g,解得x=0.02mol,y=0.01mol,所以该合金中n(Cu):n(Mg)=2:1,正确;B.在反应过程中金属失去电子的物质的量与硝酸变为氮的氧化物得到的电子的物质的量相等,也等于金属离子变为氢氧化物时结合的OH-的物质的量。n(e-)=(0.02mol+0.01mol )×2=0.06mol,由于硝酸得到电子产生的氧化物的化合价为+4价,所以发生还原反应的硝酸的物质的量是0.06mol,故反应消耗的硝酸的物质的量是n(HNO3)= (0.02mol×2+0.01mol×2)+ 0.06mol=0.12mol,63%的浓硝酸的物质的量浓度是c(HNO3)= (1.40×1000×63%)÷63=14mol/L,所以反应后硝酸的物质的量浓度是(14mol/L×0.05L-0.12mol)÷0.05L=11.6mol/L,由于硝酸是一元强酸,所以合金完全溶解时,溶液中c(H+)=11.6mol/L,错误;C.假设NO2和N2O4的混合气体中,NO2的物质的量是m, N2O4的物质的量是n,则m+n=1.120L÷ 22.4L/mol =0.05mol,m+2n=0.06mol,解得m=0.04mol,n=0.01mol,所以NO2的物质的量占总物质的量的比例(0.04mol ÷0.05mol)×100%=80%,对于气体来说,在相同外界条件下,体积比等于物质的量的比,因此NO2和N2O4的混合气体中,NO2的体积分数是80%,正确;D.向含有硝酸的硝酸铜、硝酸镁的混合溶液中加入NaOH溶液,碱先与过量的酸发生反应,然后在与盐反应。所以得到2.54g沉淀时,溶液为硝酸钠,应该是总硝酸的物质的量去掉变为N的氧化物的部分,n(NaOH)= 14mol/L× 0.05L— 0.06mol =0.64mol,所以加入NaOH溶液的体积是V(NaOH0=0.64mol÷1.0mol/L=0.64L= 640 mL,错误。
考点:考查守恒方法在氧化还原反应方程式的计算中的应用的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年北京市海淀区高三上学期期末化学试卷(解析版) 题型:选择题
室温下,下列有关两种溶液的说法不正确的是
序号 | ① | ② |
pH | 12 | 12 |
溶液 | 氨水 | 氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省红河州高三统一检测理综化学试卷(解析版) 题型:填空题
(14分)氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害。
Ⅰ.氨气是一种重要的化工原料。
(1)NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g) +2NH3(g) (NH2)2CO(s) +H2O(g) ,在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:
(NH2)2CO(s) +H2O(g) ,在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:

则A点的逆反应速率V(逆)(CO2) B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 。
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s) 2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
2 NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为 。该反应的化学平衡常数的表达式为________。
Ⅱ.氮的氧化物会污染环境。
(3)采取还原法,用炭粉可将氮的氧化物还原。
已知:N2(g)+O2(g)=2NO(g) △H= +180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) △H= —393.5 kJ·mol-1
写出炭粉还原一氧化氮的热化学反应方程式 。
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为________。若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省部分高三1月份统一考试理综化学试卷(解析版) 题型:选择题
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
C.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共8分)
化合物E是一种化工产品,可以通过下图所示的路线合成:
已知: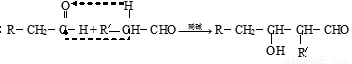
45.化合物II的结构简式为:
46.写出化合物III与新制氢氧化铜反应的化学方程式:
47.下列说法正确的是
A.化合物I遇氯化铁溶液能显色
B.化合物II能与NaHCO3溶液反应
C.1mol化合物III最多能与3mol H2反应
D.1mol化合物E完全燃烧消耗9.5mol O2
48.有机物R(C9H9ClO3)经过反应也可制得化合物E,则R在NaOH醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应2R(气) 5Q(气)
5Q(气)  4X(气)+ nY(气),反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
4X(气)+ nY(气),反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市崇明县高三上学期期末考试化学试卷(解析版) 题型:选择题
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是

A.用装置甲氧化废液中的溴化氢 B.用装置以分离油层和水层
C.用装置甲分离四氯化碳和液溴 D.用仪器丁密封存放单质溴
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三元月模拟测试化学试卷(解析版) 题型:选择题
将3.84g铜粉加入到80mL lmol·L-1的稀硝酸溶液中,充分反应后,再向溶液中加入下列物质,充分搅拌后,铜粉仍然不能完全溶解的是
A.80mL l mol·L-1的稀硝酸溶液 B.80mL 0.5mol·L-1的稀盐酸
C.80mL lmnl·L-1的FeCl3溶液 D.80mL 0.5mol·L-l的稀硫酸溶液
查看答案和解析>>
科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:选择题
下列物质放置在空气中变质,不是因为发生氧化还原反应而变质的是
A.Na B.Na2O2 C.Na2O D.FeCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com