
| A. | 白醋的醋味源于乙醇 | B. | 米酒主要成分为乙酸 | ||
| C. | 二者均为无机物 | D. | 二者在一定条件下可发生反应 |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 阴阳离子间通过静电吸引形成的化学键叫做离子键 | |
| B. | HF,HCl,HBr,HI的热稳定性和酸性均依次减弱 | |
| C. | 元素非金属越强,其对应含氧酸的酸性就越强 | |
| D. | 元素周期律是元素原子核电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z可以组成一种Y和Z的质量比为7:20的化合物 | |
| B. | X、Y、Z组成的一种离子化合物,其中X、Y、Z元素原子个数比可能为4:2:3 | |
| C. | X和Z可以形成X2Z和X2Z2型化合物,所含共价键类型不完全相同 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)2 | D. | Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为131 | B. | 质子数为131 | C. | 质量数53 | D. | 电子数53 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水洗涤试管内壁上的“银镜” | |
| B. | 只用溴水鉴别苯、CCH4、KI溶液、Na2SO4溶液 | |
| C. | 为加快过滤速度,用玻璃棒搅拌过滤器中的食盐水 | |
| D. | 为迅速除去乙酸乙酯中的少量乙酸,加入足量NaOH溶液并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| B. | Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| C. | 配制FeCl3溶液,应加少量盐酸 | |
| D. | 将Al2(SO4)3溶液蒸干,灼烧得Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
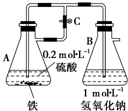 当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com