
 W、X、Y、Z分别为H、C、N、O元素.
W、X、Y、Z分别为H、C、N、O元素.分析 (1)由CH4、O2和KOH溶液组成的新型燃料电池,负极上发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水;
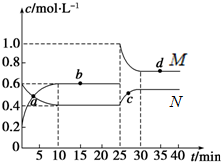
(2)①物质的浓度不发生变化时表示化学反应处于平衡状态;
②由图象曲线变化可知,在10min时,N浓度变化量为0.4mol/L,M浓度变化量为0.2mol/L,则N为NO2的变化曲线,M为N2O4的变化曲线,25min瞬间,N2O4的浓度不变,NO2的浓度变为1mol/L,应是加入NO2,根据浓度变化量计算加入NO2的物质的量;
③c(NO2)越大,颜色越深.
解答 解:(1)由CH4、O2和KOH溶液组成的新型燃料电池,负极上发生氧化反应,甲烷在负极失去电子,碱性条件下生成碳酸根离子与水,负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;
(2)①物质的浓度不发生变化时表示化学反应处于平衡状态,由图可知,处于平衡状态的点是b和d,
故选:bd;
②由图象曲线变化可知,在10min时,N浓度变化量为0.4mol/L,M浓度变化量为0.2mol/L,则N为NO2的变化曲线,M为N2O4的变化曲线,25min瞬间,N2O4的浓度不变,NO2的浓度变为1mol/L,应是加入NO2,ze 加入NO2的物质的量2L×(1mol/L-0.6mol/L)=0.8mol,
故答案为:NO2;0.8;
③c(NO2)越大,颜色越深,故颜色由深到浅的顺序是c、d、b、a,
故答案为:c、d、b、a.
点评 本题考查化学平衡图象、原电池,明确图象中纵横坐标及点、线、面的意义,关键是判断N、M所代表的物质,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
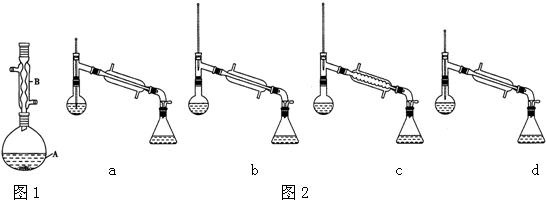
| 相对原子质量 | 密度/(g.cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.813 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊醇 | 130 | 0.8670 | 142 | 难溶 |
 +
+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ 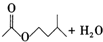
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40Wg | B. | 80ng | C. | 5(m-n)g | D. | mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )
分子模型可以直观地表现分子结构的特点.如图表示某烃分子的一种模型,有关说法中正确的是( )| A. | 该图表示的是乙烯分子的球棍模型 | |
| B. | 该烃分子是非极性分子 | |
| C. | 该烃的电子式为: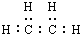 | |
| D. | 该烃分子中半径较大的原子其核外电子排布的轨道表示式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
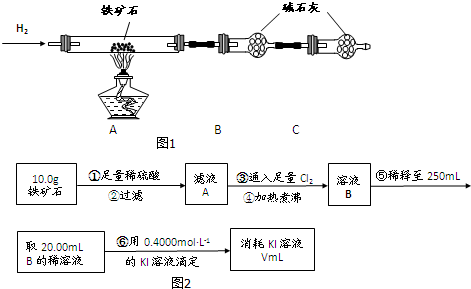
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 1:7 | C. | 2:11 | D. | 16:25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com