
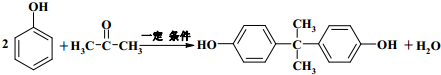
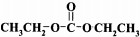 +2ROH$\stackrel{催化剂}{→}$
+2ROH$\stackrel{催化剂}{→}$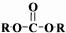 +2CH3CHOH(R为烃基)
+2CH3CHOH(R为烃基)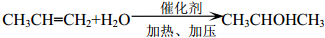 .
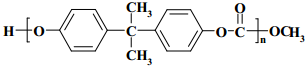
. .
. .
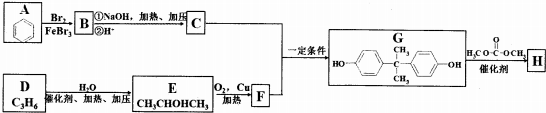
.分析 A与溴发生取代反应生成B为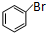 ,B转化得到C为
,B转化得到C为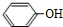 .结合E的结构可知D与水发生加成反应生成E,则D为CH3CH=CH2,E发生氧化反应生成F为
.结合E的结构可知D与水发生加成反应生成E,则D为CH3CH=CH2,E发生氧化反应生成F为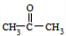 ,苯酚与丙酮褪去1分子水生成G,G发生信息中的取代反应得到聚碳酸酯H为
,苯酚与丙酮褪去1分子水生成G,G发生信息中的取代反应得到聚碳酸酯H为 .
.
解答 解:A与溴发生取代反应生成B为 ,B转化得到C为
,B转化得到C为 .结合E的结构可知D与水发生加成反应生成E,则D为CH3CH=CH2,E发生氧化反应生成F为
.结合E的结构可知D与水发生加成反应生成E,则D为CH3CH=CH2,E发生氧化反应生成F为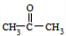 ,苯酚与丙酮褪去1分子水生成G,G发生信息中的取代反应得到聚碳酸酯H为
,苯酚与丙酮褪去1分子水生成G,G发生信息中的取代反应得到聚碳酸酯H为 .
.
(l)E的化学名称是:2-丙醇,G中含有的官能团名称是羟基,A→B反应类型是取代反应,
故答案为:2-丙醇;羟基;取代反应;
(2)D→E的化学方程式是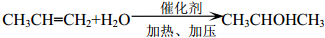 ,
,
故答案为: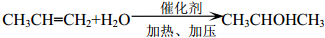 ;
;
(3)C+F→G的化学方程式是 ,
,
故答案为: ;
;
(4)聚碳酸酯H的结构简式是 ,
,
故答案为: ;
;
(5)同时满足下列条件的G的同分异构体:①只含有一个苯环;②苯环上连有3条侧链,其中有2个为-CH=CHCHO,另外取代基为-CH2CH2CH3或-CH(CH3)2,2个为-CH=CHCHO处于邻位时,-CH2CH2CH3或-CH(CH3)2有2种位置,2个为-CH=CHCHO处于间位时,-CH2CH2CH3或-CH(CH3)2有3种位置,2个为-CH=CHCHO处于对位时,-CH2CH2CH3或-CH(CH3)2有1种位置,故共有12种,
故答案为:12.
点评 本题考查有机物的推断与合成、有机物命名、官能团、有机反应类型、限制条件同分异构体书写等,注意熟练掌握官能团的性质与转化,较好的考查学生分析推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为lNA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C一H键数目一定为0.5NA | |
| C. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA | |
| B. | 标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA | |
| C. | 常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算 | |
| D. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g冰的晶体中含有氢键的数目为2 NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA | |
| D. | 1 mol C12与足量NaOH溶液反应,转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molNaN3所含阴离子总数为3NA | |
| B. | 常温常压下,28 g乙烯气体中σ键与π键数目之和为6NA | |
| C. | 标准状况下,22.4L C12通入到足量FeBr2溶液中,被氧化的Br-数目为2NA | |
| D. | 500 mL 18 mol/L的H2SO4溶液与足量Cu共热,电子转移数目为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
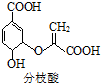
| A. | 分子中含有3种含氧官能团 | |
| B. | 可发生取代、加成、消去、加聚等反应 | |
| C. | 该物质的分子式为C10H10O6 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的热稳定性:D>E | |
| B. | 原子半径:A<B<C<D<E | |
| C. | B与C形成的化合物中不可能含共价键 | |
| D. | 最高价氧化物对应的水化物酸性最强的是E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com