
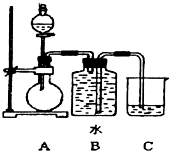
 如图装置可以用来制取某些气体.
如图装置可以用来制取某些气体.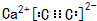 (填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.
(填电子式)分液漏斗中盛放的是饱和食盐水,目的是使反应产生乙炔的速率平缓.分析 (1)实验室常用块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔制备乙炔据此结合装置进行解答;
(2)实验室中制备乙炔的反应原理块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔;
(3)制取的乙炔气体通常混有H2S气体,通过硫酸铜溶液除去;
(4)根据该装置为固体和液体反应不需要加热的反应,生成的气体可用排水法收集,据此解答;
(5)用乙醇制取乙烯时的温度计,因测量的溶液的温度,需将温度计的下端插入液面以下;加热还需酒精灯;乙醇在浓硫酸加热170℃发生消去反应.
解答 解:(1)制取乙炔反应为固体和液体不需加热的反应,实验室常用块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔反应为:CaC2+2H2O→Ca(OH)2+C2H2↑,分液漏斗装的是液体药品,所以圆底烧瓶中盛放的物质是固体CaC2,属于离子化合物,电子式为: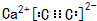 ,分液漏斗中盛放饱和食盐水减弱反应的剧烈程度,使反应产生乙炔的速率平缓,
,分液漏斗中盛放饱和食盐水减弱反应的剧烈程度,使反应产生乙炔的速率平缓,
故答案为: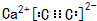 ;饱和食盐水;使反应产生乙炔的速率平缓;
;饱和食盐水;使反应产生乙炔的速率平缓;
(2)实验室中制备乙炔的反应原理块状固体碳化钙(CaC2)与水反应生成氢氧化钙[Ca(OH)2]和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(3)制取的乙炔气体通常混有H2S气体,通过硫酸铜溶液除去,CuSO4+H2S=CuS↓+H2SO4,故答案为:CuSO4溶液;
(4)该装置为固体和液体不需要加热的反应,分液漏斗装的是液体药品,可以通过控制分液漏斗滴加液体速率,来控制反应的速度,生成的气体难溶于水,可用排水法收集,实验室用过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,生成的氧气难溶于水,可用该装置;实验室用锌粒与稀硫酸反应制备氢气,Zn+H2SO4=ZnSO4+H2↑,生成的氢气难溶于水,可用该装置;
故答案为:O2或H2;
(5)乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,因需测量溶液的温度,用乙醇制取乙烯时的温度计下端需插入液面以下,加热还需酒精灯,
故答案为:插入液面下;酒精灯.
点评 本考点主要考查气体的制取装置和收集装置的选择,注意气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关,题目难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H5OH $→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O | |
| B. | CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O | |
| C. | CH3-CH=CH2+Br2→CH3-CHBr-CH2Br | |
| D. |  +Br2 $\stackrel{Fe}{→}$ +Br2 $\stackrel{Fe}{→}$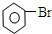 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与浓溴水反应生成三溴苯酚 | B. | 苯酚能和NaOH溶液反应 | ||
| C. | 苯酚燃烧产生带浓烟的火焰 | D. | 甲苯能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
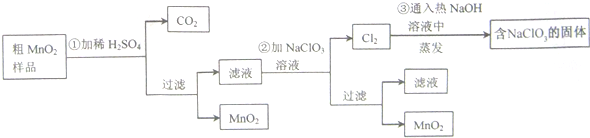
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com