

| A. | A能发生消去反应 | |
| B. | A的相对分子质量是43 | |
| C. | A含有的含氧官能团的名称是酯基 | |
| D. | A有多种同分异构体,其中能与新制Cu(OH)2共热,产生红色沉淀的仅有1种 |
分析 根据质荷比可知,有机物A的相对分子质量为74,由核磁共振氢谱可知,该有机物分子中有2中化学环境不同的H原子,2种H原子数目之比为1:1,结合红外光谱可知,其结构为CH3COOCH3,含有酯基,酯在碱性条件下水解生成酸钠和醇,据此分析.
解答 解:根据质荷比可知,有机物A的相对分子质量为74,由核磁共振氢谱可知,该有机物分子中有2中化学环境不同的H原子,2种H原子数目之比为1:1,结合红外光谱可知,其结构为CH3COOCH3,含有酯基,酯在碱性条件下水解生成酸钠和醇,
A.A属于酯类物质不能发生消去反应,故A错误;
B.由质谱图可知,有机物A的相对分子质量为74,故B错误;
C.由分析可知,A的结构为CH3COOCH3,含有酯基,故C正确;
D.A的同分异构体,中能与新制Cu(OH)2共热生成红色沉淀的,有HCOOCH2CH3、HOCH2CH2CHO,两种同分异构体,故D错误.
故选C.
点评 本题考查了有机物的结构与性质,注意对红外光谱和核磁共振氢谱的简单识图、有机物的结构与性质,题目难度较小,注意核磁共振氢谱只能确定H原子种类,峰的面积之比等于H原子数目之比,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-) | |
| D. | 相同浓度的三种溶液①CH3COONa ②NaHCO3③NaClO的pH大小比较:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 严格执行机动车尾气排放标准有利于防止大气污染 | |
| B. | 使用二氧化硫增白的食品对人体健康产生损害 | |
| C. | 使用氯气对自来水消毒时生成的有机氯化物可能对人体有害 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质的溶解开始后,只有电解质的溶解过程,没有电解质的析出过程 | |
| B. | 沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 | |
| C. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| D. | 沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g白磷(P4)中所包含的P-P共价键有0.6NA | |
| B. | 40 g SiC晶体中含有NA个SiC分子 | |
| C. | 1mol淀粉(C6H10O5)n水解后产生葡萄糖的分子数一定为NA | |
| D. | 标准状况下,2molNa2O2与44.8LSO2反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- | |
| B. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- | |
| C. | 水电离的H+浓度为10-12mol•L-1的溶液中:Cl-、CO32-、NO3-、SO32- | |
| D. | 使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
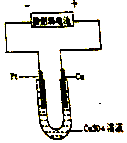 肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物一定是酸性氧化物 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 分子中含有几个氢原子就是几元酸 | |
| D. | 酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com