
| A. | 低温高压 | B. | 高温高压 | C. | 低温低压 | D. | 高温低压 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}$U相对原子质量为235 | |
| B. | ${\;}_{92}^{235}$U中的中子数为92 | |
| C. | ${\;}_{92}^{235}$U与 ${\;}_{6}^{12}$C的质量比约为235:12 | |
| D. | ${\;}_{92}^{235}$U 与${\;}_{92}^{238}$U互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | X元素可形成自然界中硬度最大的物质 |
| Y | 其单质为双原子分子,其最简单氢化物的水溶液能使酚酞变红 |
| Z | Z是短周期内最容易失去电子的元素 |
| M | M的一种同位素的质量数为34,中子数为18 |
| N | N是具有紫红色光泽的金属,有很好的延展性、导热性和导电性 |
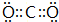 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2与Cl2,H2的分子数一定比Cl2多 | |
| B. | 0.5mol氢的质量是0.5g | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com