
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
分析 钠投入氯化亚铁溶液中,钠是活泼金属,不能置换铁,钠先和水反应生成氢氧化钠和氢气,生成的氢氧化钠和氯化亚铁反应生成氢氧化亚铁白色沉淀,氢氧化亚铁被空气中的氧气氧化迅速变化为灰绿色最后变化为红褐色氢氧化铁沉淀,氧化还原反应中元素化合价升高失电子发生氧化反应,元素化合价降低得到电子发生还原反应.
解答 解:钠投入氯化亚铁溶液中,钠是活泼金属,不能置换铁,钠先和水反应生成氢氧化钠和氢气,2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和氯化亚铁反应生成氢氧化亚铁白色沉淀,Fe2++2OH-=Fe(OH)2↓,氢氧化亚铁被空气中的氧气氧化迅速变化为灰绿色最后变化为红褐色氢氧化铁沉淀,4Fe(OH)2+2H2O+O2=4Fe(OH)3,
A.钠是活泼金属在盐的水溶液中先和水反应,不能发生置换反应,故A错误;
B.钠先和水反应生成氢氧化钠和氢气,有气体生成,生成的氢氧化钠和氯化亚铁反应生成氢氧化亚铁白色沉淀,氢氧化亚铁被空气中的氧气氧化迅速变化为灰绿色最后变化为红褐色氢氧化铁沉淀,故B错误;
C.钠和水反应中,水是氧化剂,氢氧化亚铁被氧化为氢氧化铁,氧化剂为氧气,氧化剂有水和氧气,故C错误;
D.2Na+2H2O=2NaOH+H2↑,反应中钠元素被氧化,4Fe(OH)2+2H2O+O2=4Fe(OH)3,反应中铁元素被氧化,被氧化的元素有钠、铁两种元素,故D正确;
故选D.
点评 本题考查了钠、铁及其化合物性质的分析判断,注意掌握物质性质和反应特征的理解应用,题目较简单.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 | 离子反应 |
| A | 向FeCl2溶液中加入Zn片 | 浅绿色溶液变为无色 | Zn具有还原性 | Fe2++Zn═Zn2++Fe |
| B | 向FeCl2溶液中滴新制氯水 | 浅绿色溶液变为棕黄色 | Fe2+具有还原性 | 2Fe2++Cl2═2Fe3++2Cl- |
| C | 向FeCl3溶液中加入铁粉 | 棕黄色溶液变为浅绿色 | Fe具有还原性 | Fe+Fe3+═2Fe2+ |
| D | 向FeCl3溶液中加入铜粉 | 蓝色溶液变为棕黄色 | Fe3+具有氧化性 | Fe3++Cu═Fe2++Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH的碱性比LiOH的弱 | |
| B. | HCl、HBr、HI的热稳定性依次增强 | |
| C. | HClO4的酸性比H2SO4强说明氯元素的非金属性比硫元素强 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:M>R |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
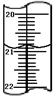 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
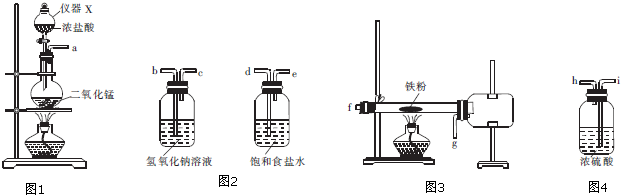
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com