

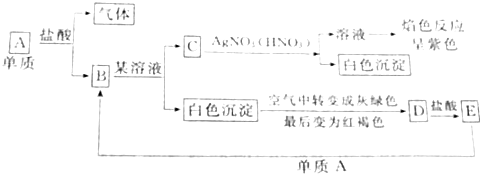
分析 A是一种固体单质,系列转化得到C,C与过量的盐酸反应得到白色沉淀E,则E为H2SiO3,C为硅酸盐,A为Si,B为SiO2,a为强碱溶液等,F为氢气、D为水,据此解答.
解答 解:A是一种固体单质,系列转化得到C,C与过量的盐酸反应得到白色沉淀E,则E为H2SiO3,C为硅酸盐,A为Si,B为SiO2,a为强碱溶液等,F为氢气、D为水.
(1)B和a溶液反应的离子方程式是:SiO2+2OH-=SiO32-+H2O,故答案为:SiO2+2OH-=SiO32-+H2O;
(2)A和a溶液反应的离子方程式是:Si+2OH-+H2O=SiO32-+2H2↑,故答案为:Si+2OH-+H2O=SiO32-+2H2↑;
(3)C和过量盐酸反应的离子方程式是:SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓.
点评 本题考查无机物推断,涉及Si元素单质化合物性质,C与过量盐酸反应得到白色沉淀为推断突破口,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据图示填空:
根据图示填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体E呈红棕色,不能直接排放 | |
| B. | 溶液S中所含溶质、沉淀R都可用作药物 | |
| C. | 合金样品中Cu的质量分数为$\frac{a-b-c}{a}$×100% | |
| D. | 合金样品中Al的质量分数为$\frac{9c}{17a}$×100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol•L-1H2SO4溶液,试管口出现红棕色气体,说明溶液中NO3-被Fe2+还原为NO2 | |
| C. | 将某气体通入品红溶液中,品红褪色,说明该气体一定是SO2 | |
| D. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将80 g NaOH溶于2 L 水所得的溶液 | |
| B. | 将0.5 mol•L-1的NaNO3溶液100 mL 加热蒸发掉50 g水所得的溶液 | |
| C. | 将40 g NaOH 溶于水并配成1 L的溶液 | |
| D. | 含K+为4 mol•L-1的K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com