
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示,则下列各项判断正确的是( )
第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
第四组 | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
A.abc的化学式分别为Ne2、Br2、HF
B.第三组与第四组相比较,化合物的稳定顺序为:HBr<d
C.第三组物质溶于水后,溶液的酸性c最强
D.第四组物质中H2O的沸点最高,是因为H2O分子间存在氢键
D
【解析】
试题分析:A. He是惰性气体元素形成的单质。由于惰性气体的原子已经达到了稳定结构,所以是单原子分子,化学式a是He。卤素单质都是双原子分子,所以b是Br2;F原子最外层有7个电子,结合1个H原子就达到稳定结构,所以c是HF。错误。B.根据同族元素形成的化合物结构相似的性质,d是H2Se.Se和Br是同一周期的元素,由于非金属性Br>Se.元素的非金属性越强,其氢化物的稳定性就越强。所以化合物的稳定顺序为:HBr> H2Se.错误。C.同族元素形成的氢化物稳定性越弱,溶于水电离产生的离子的浓度就越大,溶液的酸性既有越强。因此第三组物质溶于水后,溶液的酸性HI最强。错误。D.一般情况下,同族元素形成的化合物性质相似。结构相似的物质,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高。但在水分子之间,由于O原子的半径较小,电负性很大。所以在分子间还存在一种叫氢键的作用力,增加了水分子之间的相互作用,因此第四组物质中H2O的沸点最高。正确。
考点:考查影响物质的性质的因素的知识。


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:2013-2014甘肃省第二学期第一学段段中检测化学试卷(解析版) 题型:填空题
可以用来鉴别甲烷和乙烯, 又可以用来除去甲烷中混有的少量乙烯的操作方法是
A.混合气通过盛酸性高锰酸钾溶液的洗气瓶
B.混合气通过盛足量溴水的洗气瓶
C.混合气通过盛水的洗气瓶
D.混合气跟氯化氢混合
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高二化学试卷(解析版) 题型:选择题
下列对一些实验事实的理论解释正确的是
选项 | 实验事实 | 理论解释 |
A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
B | CO2为直线形分子 | CO2分子中C—O是极性键 |
C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高二化学试卷(解析版) 题型:选择题
下列分子或离子中,不存在sp3杂化类型的是
A、SO42- B、NH3 C、C2H6 D、SO2
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高一化学试卷(解析版) 题型:简答题
(10分)某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
1 | Mg、Al | 稀盐酸 | 偏向Al |
2 | Al、Cu | 稀盐酸 | 偏向Cu |
3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极) (填“相同”或“不相同”)。
(2)实验3中负极反应式: ;总反应的离子方程式: 。
(3)实验4中铝作 极,电极反应式: 。
(4)解释实验5中电流计指针偏向铝的原因 。
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高一化学试卷(解析版) 题型:选择题
甲乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙容易与H2化合;②甲的气态氢化物比乙的气态氢化物稳定;③甲的氧化物对应的水化物的酸性比乙的氧化物对应的水化物酸性强;④与某金属反应时甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。
A.①②③ B.只有⑤ C.①②③④⑤ D.①②
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省下学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)/mol | 酸的浓度及体积 | 反应温度 | ||
A | Mg | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
B | Fe | 0.1 | 3mol·L-1盐酸 | 10mL | 25℃ |
C | Mg | 0.1 | 3mol·L-1硫酸 | 10mL | 25℃ |
D | Mg | 0.1 | 6mol·L-1硝酸 | 10mL | 60℃ |
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高二下学期期末考试化学试卷(解析版) 题型:选择题
如图所示装置进行实验,将液体A逐滴加入到固体B中, 下列叙述中错误的是

A.实验中仪器C可起到防止倒吸的作用
B.若A为醋酸,B为贝壳(粉状),D中盛C6H5ONa溶液,则D中溶液变浑浊
C.若A为浓氨水,B为生石灰,D中盛AgNO3溶液,则D中无现象
D.若A为食盐水,B为电石,D中盛KMnO4酸性溶液,则D中溶液紫红色褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
将纯锌片和纯铜片按图方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
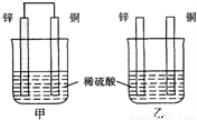
A.两烧杯中溶液的pH均增大
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中铜片表面均无气泡产生
D.甲、乙溶液均变蓝色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com