
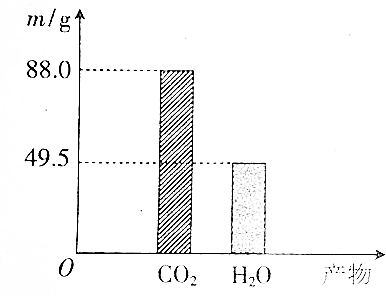
分析 (1)设混合物中含有乙醇为xmol,乙酸为ymol,根据C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O,CH3COOH+2O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O计算;
(2)乙酸与乙醇反应的方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,根据乙酸和乙醇的质量关系判断反应的过量问题,根据不足的物质结合方程式计算.
解答 解:(1)设混合物中含有乙醇为xmol,乙酸为ymol,
C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 +3H2O,
xmol 2xmol 3xmol
CH3COOH+2O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 +2H2O;
ymol 2ymol 2ymol
则2x+2y=$\frac{88}{44}$,3x+2y=$\frac{49.5}{18}$,解得$\left\{\begin{array}{l}{x=0.75}\\{y=0.25}\end{array}\right.$,则乙醇与乙酸的物质的量之比0.75:0.25=3:1;
答:混合液A中乙醇与乙酸的物质的量之比为3:1;
(2)混合物中乙醇的质量分数为$\frac{3×46}{3×46+1×60}$=0.697,则198g混合液A中含有乙醇198×0.697=138,则乙酸为198-138=60g,已知混合物A中乙醇与乙酸的物质的量之比为3:1,乙醇过量,按照乙酸计算,
则CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
60 88
60g mg
则m=$\frac{60g×88}{60}$=88g,乙酸乙酯的产率为60%,则生成的乙酸乙酯的质量是88g×60%=52.8g;
答:生成的乙酸乙酯的质量是52.8g
点评 本题考查混合物的计算、化学方程式的计算,题目难度中等大,注意反应的理论产率的运用以及反应方程式的书写,侧重于考查学生的分析能力和计算能力.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 燃烧氧化法可以对有机物进行定性与定量的元素分析 | |
| B. | 提纯液体混合物常用重结晶法 | |
| C. | 红外光谱与核磁共振氢谱可以用于确定有机物的官能团和结构式 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X可能是金属元素 | |
| B. | 由X形成的含氧酸均为强酸 | |
| C. | X不能形成化学式为KXO4的含氧酸盐 | |
| D. | 元素X的气态氢化物一定极易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
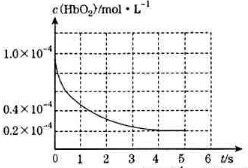 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 反应开始至4s内用HbO2表示的平均反应速率为2×10-4mol/(L•s) | |
| B. | 反应达平衡之前,O2与HbO2的反应速率逐渐减小 | |
| C. | 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 | |
| D. | 该温度下反应CO+HbO2?O2+HbCO的平衡常数为107 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 甲苯(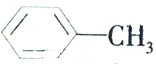 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
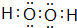 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
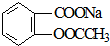 转变为
转变为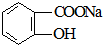 的方法为( )
的方法为( )| A. | 与足量NaOH溶液共热后,再通入CO2 | |
| B. | 与足量NaOH溶液共热后,再加入稀硫酸 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com