
【题目】用含FeCl2杂质的氯化铜晶体制纯净CuCl2·2H2O的过程是:先将晶体配制成水溶液,然后按如下图步骤进行提纯:
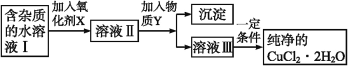
已知:在上述流程条件下,Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______。得到溶液II,最适合作氧化剂X的是______(选填以下编号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)为了除去Fe3+,需加入物质Y调节溶液的pH范围是_________________
(3)溶液Ⅲ得到CuCl2·2H2O晶体的操作是:蒸发浓缩,冷却结晶,____,___,干燥。
【答案】将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离 C 3.2~4.7之间 过滤 洗涤
【解析】
(1)根据表中数据,应将Fe2+转化成Fe3+,即氧化剂X的作用是将Fe2+氧化成Fe3+,便于生成Fe(OH)3而与Cu2+分离;加入氧化剂不能引入新杂质,A、加入K2Cr2O7引入K+和Cr3+,故A不符合题意;
B、加入NaClO,引入Na+,故B不符合题意;
C、H2O2为绿色氧化剂,不引入新杂质,故C符合题意;
D、加入KMnO4,引入K+和Mn2+,故D不符合题意;
(2)调节pH,应将Fe3+完全转变成沉淀,Cu2+不能沉淀,因此调节pH的范围是3.2≤pH<4.7;
(3)得到CuCl2·2H2O,采用操作步骤是蒸发浓缩,冷却结晶、过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】(1)写出下列有机物的系统命名或结构简式
① _____________________
_____________________
② (CH3)2CH(CH2)3CH3 _____________________
③3,4-二甲基-4-乙基庚烷_____________________
④2,3,4-三甲基戊烷_____________________
(2)写出C5H12 的同分异构的结构简式并用系统命名法命名_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法不正确的是( )

A.温度为78 ℃时固体物质M的化学式为FeSO4·4H2O
B.取适量380 ℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159 ℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出解释下列事实的离子方程式:
(1)FeCl3水溶液呈酸性:_________
(2)用Na2CO3溶液浸泡含有CaSO4的水垢:_________
(3)用稀硫酸酸化的KI淀粉溶液在空气中久置后变蓝:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. e、f两管中的试剂可以分别是浓氨水和NaOH固体
B. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在严格无氧的条件下,碱与亚铁盐溶液反应生成白色胶状的 Fe(OH)2,在有氧气的情况下迅速 变为灰绿色,逐渐形成红褐色的氢氧化铁,故在制备过程中需严格无氧。现提供制备方法如下:
方法一:用 FeSO4 溶液与用不含 O2 的蒸馏水配制的 NaOH 溶液反应制备。
(1)配制 FeSO4 溶液时需加入铁粉的原因是_____;除去蒸馏水中溶解的 O2常采用_____的方法。
(2)生成白色 Fe(OH)2 沉淀的操作是用长滴管吸取不含 O2 的 NaOH 溶液,插入 FeSO4 溶液液面下,再挤出 NaOH 溶液。这样操作的理由是_____。
方法二:
在如图装置中,用 NaOH 溶液、铁屑、稀 H2SO4 等试剂制备。

(1)在试管Ⅰ里加入的试剂是_____;
(2)在试管Ⅱ里加入的试剂是_____;
(3)为了制得白色 Fe(OH)2 沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤 是_____。
(4)这样生成的 Fe(OH)2 沉淀能较长时间保持白色,其理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=11的NaOH溶液和CH3COONa溶液各5 mL,分别稀释至500mL,溶液的pH与溶液体积(V)的关系如图所示,下列说法正确的是

A. a>9
B. 稀释后的溶液耗酸量相等
C. 曲线y表示NaOH溶液的变化
D. N、P、M点对应的溶液中水的电离程度依次增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com