
【题目】下列实验正确的是( )
A. 蒸发、浓缩、结晶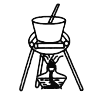
B. 检查装置气密性
C. 碳酸氢钠热分解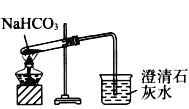
D. 分离沸点不同且互溶的液体混合物
【答案】B
【解析】
A、蒸发、浓缩、结晶应该在蒸发皿中进行;
B、向装置中的长颈漏斗中加入水,通过观察液面变化能够检验装置的气密性;
C、给固体加热时试管口应该稍稍向下倾斜;
D、蒸馏装置中,温度计用于测量馏分温度,不能插入混合液中。
A、蒸发、浓缩、结晶操作应该使用蒸发皿,不能选用坩埚,故A错误;
B、用弹簧夹夹住右边导管,向长颈漏斗中倒水,当液面高度不变时,说明装置气密性良好,所以能检查装置气密性,故B正确;
C、碳酸氢钠受热分解会生成水,大试管口应该稍向下倾斜,否则可能导致大试管炸裂,故C错误;
D、分离沸点不同且互溶的液体混合物,需要使用温度计测量温度控制馏分成分,温度计不能插入溶液中,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4- 、Fe(SCN)3 等。
(1)基态铁原子核外电子排布式为________________.
(2)科学研究表明用 TiO2 作光催化剂可将废水中 CN- 转化为OCN-,并最终氧化为 N2 、CO2。OCN- 中三种元素的第一电离能由大到小的顺序为_________。
(3)与 CN- 互为等电子体的一种分子为________________(填化学式);1mol Fe(CN)63- 中含有![]() 键的数目为________________。
键的数目为________________。
(4)铁的另一种配合物Fe(CO)5 熔点为 —20.5℃,沸点为 103℃,易溶于CCl4,据此可以判断Fe(CO)5 晶体属于________________(填晶体类型)。
(5)铁铝合金的一种晶体属于体心立方结构,其晶胞可看成由 8 个小体心立方结构堆砌而成。已知小立方体如图所示,该合金的化学式为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3 溶液存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法正确的是()
HCO3-+OH-。下列说法正确的是()
A.加入 NaOH 固体,溶液 pH 减小
B.稀释溶液,水解平衡常数增大
C.升高温度,![]() 减小
减小
D.加入 CaCl2 固体,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铜投入浓硝酸中:Cu + 2NO![]() + 2H+ = Cu2+ + 2NO↑+ H2O
+ 2H+ = Cu2+ + 2NO↑+ H2O
B.氧化铝投入稀盐酸中:Al2O3 + 6H+ =2Al3+ + 3H2O
C.钠和水反应:Na + H2O = Na+ + OH- + H2↑
D.用食醋溶解氢氧化镁:Mg(OH)2+2H+=Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
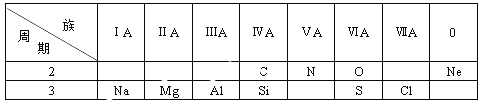
(1)金属性最强的元素是___________;
(2)最外层电子数为8的原子是___________;
(3) O和S二者原子半径较大的是___________;
(4)可用于制造光导纤维的氧化物是___________;
(5)CH4和SiH4二者热稳定性较强的是___________;
(6)MgO和Al2O3中,能与强碱溶液反应的是_____________;
(7)NaOH和Mg(OH)2中,碱性较弱的是___________;
(8)NO在空气中会变成红棕色的NO2,写出该反应的化学方程式___________;
(9)HClO4中氯元素的化合价是______;1mol HClO4含有_________mol O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组采用下图实验装置及相应操作制取纯碱。实验时,广口瓶中反应的化学方程式为:NH3+CO2+H2O+NaCl= NaHCO3↓+NH4Cl。下列分析正确的是
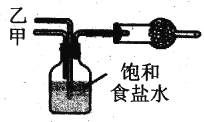
A. 导气管乙应该通入氨气
B. 导气管甲应先于乙通入气体
C. 干燥管中应盛装碱石灰
D. 广口瓶最好置于热水浴中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图回答:
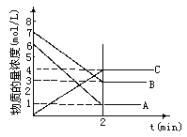
(1)反应物是__________;.
(2)2min内A的平均速率是________;
(3)写出化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 向Ca(ClO)2溶液中通入少量CO2:2ClO+CO2+H2O2HClO+![]()
B. 向AgCl悬浊液中加入Na2S溶液,白色沉淀变成黑色:2AgCl+S2Ag2S+2Cl
C. 用强碱溶液吸收工业尾气制取硝酸:NO+NO2+2OH2![]() +H2O
+H2O
D. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:![]() +Fe2++3OHNH3·H2O+Fe(OH)2↓
+Fe2++3OHNH3·H2O+Fe(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
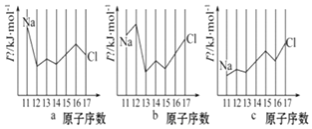
【题目】电离能是衡量元素失电子能力的重要依据,随着元素核电荷数的递增,电离能值呈现周期性变化规律。根据所学知识,回答下列问题。
![]() 第一电离能指的是______。
第一电离能指的是______。
![]() 如图是部分元素原子的第一电离能
如图是部分元素原子的第一电离能![]() 随原子序数变化关系
随原子序数变化关系![]() 其中12号至17号元素的有关数据缺失
其中12号至17号元素的有关数据缺失![]() 。
。
![]() 根据图示变化规律,可推测S的第一电离能的大小
根据图示变化规律,可推测S的第一电离能的大小![]() 最小
最小![]() 范围为______
范围为______![]() ______
______![]() 填元素符号
填元素符号![]() 。
。
![]() 据图可知,同主族元素原子第一电离能
据图可知,同主族元素原子第一电离能![]() 变化规律是______。
变化规律是______。
![]() 图中第一电离能最小的元素在周期表中的位置______。
图中第一电离能最小的元素在周期表中的位置______。
![]() 根据对角线规则铍元素最高价氧化物的水化物应该具有______。
根据对角线规则铍元素最高价氧化物的水化物应该具有______。
![]() 用In表示元素的第n电离能,则图中的a、b、c分别代表______。
用In表示元素的第n电离能,则图中的a、b、c分别代表______。
A.a为![]() 、b为
、b为![]() 、c为
、c为![]()
B.a为![]() 、b为
、b为![]() 、c为
、c为![]()
C.a为![]() 、b为
、b为![]() 、c为
、c为![]() D.a为
D.a为![]() 、b为
、b为![]() 、c为
、c为![]()
![]() 铜、锌两种元素的第一电离能、第二电离能如表所示:
铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能 |
|
|
Cu | 746 | 1958 |
Zn | 906 | 1733 |
铜的第一电离能![]() 小于锌的第一电离能,而铜的第二电离能
小于锌的第一电离能,而铜的第二电离能![]() 却大于锌的第二电离能,其主要原因是______。
却大于锌的第二电离能,其主要原因是______。
![]() 与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能
与电离能的定义相类似,元素的气态基态原子得到一个电子形成气态负一价阴离子时所放出的能量称作第一电子亲和能![]() ,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能
,负一价阴离子再获得一个电子的能量变化叫做第二电子亲和能![]() ,部分元素或离子的电子亲和能数据如下表所示:
,部分元素或离子的电子亲和能数据如下表所示:
元素 | Cl | Br | I | O |
|
电子亲和能 | 349 | 343 | 295 | 141 |
|
![]() 下列说法中错误的是______。
下列说法中错误的是______。
A.元素的电子亲和能越大,越容易得到电子
B.一个基态的气态氧原子得到一个电子成为![]() 时放出141kJ的能量
时放出141kJ的能量
C.氧元素的第二电子亲和能是![]()
D.基态的气态氧原子得到两个电子成为![]() 需要吸收能量
需要吸收能量
![]() 图中数据显示,同主族元素
图中数据显示,同主族元素![]() 从上到下依次减小,其原因是_____。
从上到下依次减小,其原因是_____。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com