
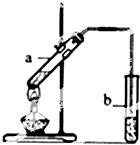
 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、混合溶液的pH=7 | ||
B、若混合溶液中c(H+)=
| ||
| C、若混合溶液pH=4,则水电离出的c(H+)=1.0×10-10mol?L-1 | ||
| D、若HA为强酸,则混合后溶液中各离子浓度的大小关系一定为:c(A-)>c(B+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 1L某混合溶液,可能含有的离子如下表:
1L某混合溶液,可能含有的离子如下表:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在H2O2溶液中加入少量MnO2粉末 |
| B、镀锌铁皮加入足量的NaOH溶液中 |
| C、1mol铜片与含2mol H2SO4的浓硫酸共热 |
| D、常温下,1mol铜片投入含4mol HNO3的浓硝酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com