
【题目】化学反应中存在两大变化,即__变化和__变化。由于断开不同的化学键__的能量不同,形成不同的化学键__的能量也不同,所以化学反应中总会伴有__的变化,最终的反应结果表现为___能量和__能量。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列几项中,在生物体内含量较少,但是对于维持生物体的正常生命活动必不可少的元素是
A. Fe、Mn、Zn、Mg B. Cu、Zn、Mn、K
C. Mn、Zn、B、Cu D. Cu、N、S、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 明矾水解生成Al(OH)胶体,可用作净水剂
D. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于细胞内化合物的叙述,正确的是
A. 蛋白质是生命活动的主要承担者
B. 淀粉是植物细胞壁的主要成分
C. DNA是一切生物的遗传物质
D. 染色体主要由RNA和蛋白质组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能够达到要求的是( )
A. 用托盘天平称量25.20gNaCl
B. 用10mL的量筒量取7.50mL稀硫酸
C. 用25mL的滴定管量取14.80mL溶液
D. 用广泛pH试纸测某碱液的pH为12.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物在生产、生活中应用广泛。
Ⅰ.(1)镁在元素周期表中的位置为___________
(2)镁的碳化物常见的有MgC2和Mg2C3两种,可分别发生水解反应生成乙炔和丙二烯,写出MgC2水解反应的方程式为_________;Mg2C3的电子式为_________.
(3)由Mg可制成“镁一次氯酸盐”燃料电池,其装置示意图如下图所示,该电池反应的离子方程式为____________.
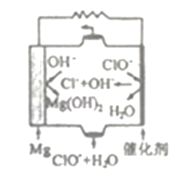
Ⅱ.利用氯碱工业盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下图所示。
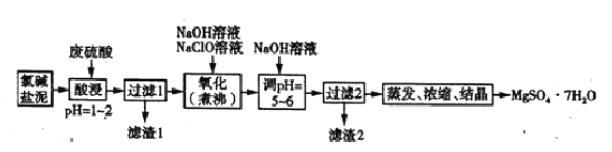
(4)酸浸时,FeCO3与硫酸反应的化学方程式为_____________,为了提高浸取率可采取的措施有_____(填字母)。
a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.适当延长浸取时间
(5)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子程式为______________;滤渣2为MnO2和_____________、___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,向2.0L恒容密闭容器中充入2mol SO2和1mol O2 , 发生反应: 2SO2(g)+O2(g)2SO3(g).经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
t/s | 0 | t1 | t2 | t3 | t4 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
下列说法正确的是( )
A.反应在前t1 s 的平均速率v(O2)= ![]() molL﹣1s﹣1
molL﹣1s﹣1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4mol SO3 , 达到平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2mol SO2、1mol O2 , 反应达到新平衡时 ![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS﹣)=1×10﹣5molL﹣1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O4﹣)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应H2+Cl2=2HCl中,已知断开1 mol H—H需要能量436 kJ,断开1 molCl—Cl需要能量243 kJ,断开1 mol H—Cl需要能量431 kJ,判断该反应是( )
A.放出83 kJ热量B.放出183 kJ热量
C.反应总能量低于生成物的总能量D.吸收183 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com