
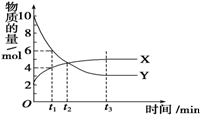
 一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )
一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示,下列叙述中错误的是( )| A. | 反应的化学方程式为7Y?3X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,反应达到平衡状态,正、逆反应速率相等 | |
| D. | t3时,反应达到平衡状态,逆反应速率等于正反应速率 |
分析 t3时,各组分的浓度不再变化,反应达到平衡状态,则t1、t2时没有得到平衡状态;根据图象可知,达到平衡时Y的物质的量为3mol,变化量为10mol-3mol=7mol,X的物质的量为5mol,变化量为5mol-2mol=3mol,反应的方程式为7Y?3X,据此进行解答.
解答 解:A.达到平衡时,Y的物质的量为3mol,变化量为:10mol-3mol=7mol,X的物质的量为5mol,变化量为:5mol-2mol=3mol,反应的化学方程式为:7Y?3X,故A正确;
B.t1时,Y的物质的量为6mol,X的物质的量为4mol,物质的量之比等于浓度之比,则Y的浓度是X浓度的1.5倍,故B正确;
C.由图可知,t3时得到平衡状态,则t2时反应没有达到平衡,此时反应继续向正方向移动,正反应速率大于逆反应速率,故C错误;
D、由图可知t3时,各组分的浓度不再变化,反应达到平衡状态,则正逆反应速率相等,故D正确;
故选C.
点评 本题考查化学平衡及其影响、化学平衡图象分析,他们的浓重的,解答时注意从反应物和生成物的物质的量的变化角度判断反应物和生成物以及反应是否达到平衡,明确化学平衡的特征为解答关键.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能通过滤纸空隙,而浊液的分散质不能 | |
| B. | 胶体粒子带电荷 | |
| C. | 分散质粒子直径在1 nm~100 nm之间 | |
| D. | 产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO(g)+O2(g)═2NO2(g) | |
| B. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3•H2O(aq) | |
| C. | 2Na2O2(s)+2CO2(g)═2Na2CO3(s)+O2(g) | |
| D. | 2NO2(g)═N2O4(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ②⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
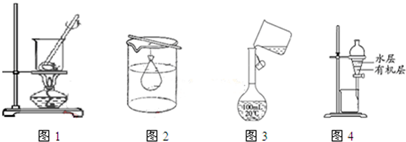
| A. | 图1:实验室灼烧胆矾测定胆矾中结晶水的含量 | |
| B. | 图2:除去Fe(OH)3胶体中的FeCl3 | |
| C. | 图3:向容量瓶中转移液体 | |
| D. | 图4:用苯萃取溴水中的Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com