
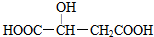 ,下列说法错误的是( )
,下列说法错误的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 苹果酸能发生取代反应、消去反应和缩聚反应 | |
| C. | 1 mol苹果酸最多可与1 mol Na2CO3发生复分解反应 | |
| D. | 与苹果酸官能团种类和个数均相同的同分异构体还有两种 |
分析 该物质中含有醇羟基和羧基,所以具有醇和羧酸的性质,能发生取代反应、氧化反应、缩聚反应、酯化反应、中和反应,据此分析解答.
解答 解:A.该物质中的羧基和醇羟基都可以发生酯化反应,所以有两种能发生酯化反应的官能团,故A正确;
B.该物质中含有醇羟基和羧基,所以具有醇和羧酸的性质,能发生取代反应、氧化反应、缩聚反应、酯化反应、中和反应,故B正确;
C.只有羧基能和碳酸钠反应,所以1 mol苹果酸最多可与2mol Na2CO3发生复分解反应,故C错误;
D.与苹果酸官能团种类和个数均相同的同分异构体还有两种

故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查羧酸和醇的性质,易错选项是D.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
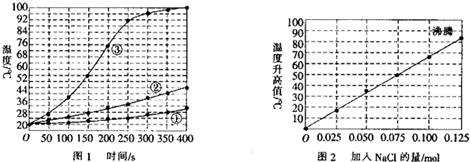
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
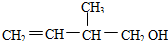 下列的叙述错误的是( )
下列的叙述错误的是( )| A. | 此有机物的官能团是羟基和碳碳双键 | |
| B. | 能在催化剂条件下与H2发生加成反应 | |
| C. | 此有机物不能发生加聚反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | “低碳”是指采用含碳量低的烃类作为燃料 | |
| C. | 银质物品久置在空气中表面变黑,是电化学腐蚀引起的 | |
| D. | 皮肤、指甲不慎沾上浓硝酸,会发生颜色反应而变黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaC2与水反应制乙炔,乙烯与水反应制乙醇--水解反应 | |
| B. | 由苯制硝基苯,由甲苯制TNT--消化反应 | |
| C. | 油脂的硬化,油脂的氢化--加聚反应 | |
| D. | 乙醇与酸性K2Cr2O7溶液反应,乙醛与新制Cu(OH)2浊液反应--氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Br2$\stackrel{光照}{→}$ CH3CH2Br+HBr | B. | CH2=CH2+HBr-→CH3CH2Br | ||
| C. | 2C2H2+5O2$\stackrel{点燃}{→}$ 4CO2+2H2O | D. | C4H10$\stackrel{高温}{→}$ C2H4+C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
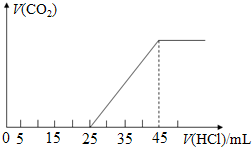
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH保持不变,乙池溶液pH减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com