
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
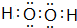 .该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑.
.该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-═CO32-+NH3↑. 分析 由元素在周期表中位置,可知A为氢,B为碳,C为氮,D为氧,E为氟,F为Na,G为Mg,H为Al,I为硫,J为Cl,K为Ar,L为钾,M为Ca.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱;稀有气体原子最外层为稳定结构,化学性质最不活泼;所有元素中H原子半径最小;
(2)C元素的气态氢化物为NH3,I元素的最高价氧化物的水化物为H2SO4,二者反应生成硫酸铵;
(3)非金属性越强,对应氢化物还原性越弱;
(4)A与D形成的化合物H2O2是共价化合物,分子中O原子之间形成1对共用电子对,氧原子与H原子之间形成1对共用电子对,该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,配平书写相应的离子方程式.
解答 解:由元素在周期表中位置,可知A为氢,B为碳,C为氮,D为氧,E为氟,F为Na,G为Mg,H为Al,I为硫,J为Cl,K为Ar,L为钾,M为Ca.
(1)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,F的非金属性最强;稀有气体原子最外层为稳定结构,Ar化学性质最不活泼;所有元素中H原子半径最小,
故答案为:钾;氟;Ar;H;
(2)C元素的气态氢化物为NH3,I元素的最高价氧化物的水化物为H2SO4,二者反应生成硫酸铵,反应方程式为:2NH3+H2SO4═(NH4)2SO4,
故答案为:2NH3+H2SO4═(NH4)2SO4;
(3)非金属性F>O>N,非金属性越强,对应氢化物还原性越弱,故氢化物还原性:HF<H2O<NH3,
故答案为:HF<H2O<NH3;
(4)A与D形成的化合物H2O2是共价化合物,分子中O原子之间形成1对共用电子对,氧原子与H原子之间形成1对共用电子对,电子式为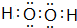 ,该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为:H2O2+CN-+OH-═CO32-+NH3↑,
,该物质可将碱性工业废水中的CNˉ氧化为碳酸盐和氨,相应的离子方程式为:H2O2+CN-+OH-═CO32-+NH3↑,
故答案为:共价;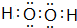 ;H2O2+CN-+OH-═CO32-+NH3↑.
;H2O2+CN-+OH-═CO32-+NH3↑.
点评 本题考查元素周期表与元素周期律综合运用,侧重对元素周期律的考查,熟练掌握前四周期元素.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与126C互为同位素 | B. | 表示碳元素的一种核素 | ||
| C. | 质量数是13,核内有6个中子 | D. | 原子序数是6,核内有7个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | 锂所在周期元素最高价氧化物对应的水化物中,酸性最强的是HNO3 | |
| D. | 与水或者酸反应的剧烈程度:K>Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | y≥1.2 | |
| B. | 增大反应体系的压强,反应速率不一定增大 | |
| C. | v正(A)>v逆(C),不可能为平衡状态 | |
| D. | 混合气体的密度不再变化,一定为平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
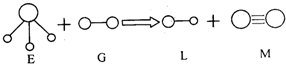
| A. | G是最活泼的非金属单质 | B. | L能使紫色石蕊试液变红色 | ||
| C. | E能使紫色石蕊试液变蓝色 | D. | M是化学性质很活泼的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2克甲苯含有的C-H数目为0.8NA | |
| B. | 1 mol羟基所含的电子数为7NA | |
| C. | 1 mol乙醇催化氧化生成乙醛时转移的电子数为4NA | |
| D. | 分子式为C3H6的有机物一定含有NA个碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com