
利用如图装置测定中和热的实验步骤如下:
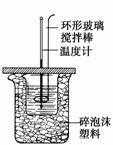
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1 NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):________________________________________________________________________
________________________________________________________________________。
(2)倒入NaOH溶液的正确操作是______(从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是______(从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温 度t2/℃ | 温度差平均值(t2-t1) /℃ | |
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
②近似认为0.55 mol·L-1 NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=
________________________________________________________________________
( 取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)
____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
答案 (1)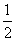 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===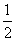 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
(2)C (3)D
(4)①3.4 ②-56.8 kJ·mol-1 ③acd
解析 (1)中和热测定实验要求尽可能减少热量损失,且保证酸和碱能充分反应,即要有一种反应物过量。
(2)NaOH溶液应一次倒入,以减少热量损失。
(3)温度计不能用来搅拌试剂,B项有热量损失,C项不可避免有液体溅出。
(4)①第2次实验的温度差与其它3次相比差别太大,应舍去;②ΔH=-(100 g×4.18×10-3 kJ·g-1·℃-1×3.4℃)÷0.025 mol=-56.8 kJ·mol-1;③测得结果小于理论值,即在实验过程中有热量损失,故a、c、d正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:

该反应的氧化剂是_________,当生成19.2gCu时,反应中转移的电子为_____mol。铜在潮湿的空气中能发生吸氧腐蚀而生成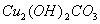 (碱式碳酸同)。该过程负极的电极反应式_______________。
(碱式碳酸同)。该过程负极的电极反应式_______________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(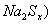 分别作为两个电极的反应物,固体
分别作为两个电极的反应物,固体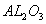 陶瓷(可传导
陶瓷(可传导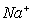 )为电解质,其原理如图所示:
)为电解质,其原理如图所示: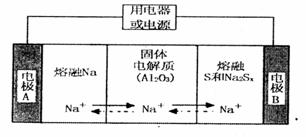
①根据下表数据,请你判断该电池工作的适宜温度应控制在_______。

②放电时,电极A为____极,S发生_______反应。
③放电时,内电路中的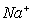 的移动方向为_______(填“从A到B”或“从B到A”)。
的移动方向为_______(填“从A到B”或“从B到A”)。
④充电时,总反应为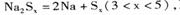 Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
Na所在电极与直流电源_______极相连,阳极的电极反应式为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
研究物质变化时,人们可以从不同的角度、不同的层面来认识物质变化时所引起的化学键及能量变化。据此判断以下叙述中错误的是( )
A.金属钠与氯气反应生成氯化钠后,其结构的稳定性增强,体系的能量降低
B.物质燃烧可看作是储存在物质内部的能量(化学能)转化为热能释放出来
C.氮气分子内部存在着很强的化学键,故通常情况下氮气的化学性质很活泼
D.需要加热才能发生的反应不一定是吸收能量的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为______________________________________。
又已知:H2O(l)===H2O(g) ΔH=44 kJ·mol-1。则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25°C、100 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+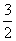 O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=1 452 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
A.稀NaOH溶液 B.HCl溶液
C.CuSO4溶液 D.酸性AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
写出用惰性电极电解下列电解质溶液的电极反应式及电解反应的化学方程式
(1)Ba(OH)2:____________________________________________________________;
(2)Na2CO3: __________________________________________________________;
(3)KCl: ____________________________________________________________;
(4)AgNO3: ___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为短周期元素。A、B可形成两种液态化合物,其最简式分别为BA和B2A,A和D可形成气态化合物DA、DA2;A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性,B和D可形成一种易溶于水的碱性气体X,B和C可形成极易溶于水的酸性气体Y,已知X分子和B2A分子中的电子数相等,Y分子的电子数与最简式为BA的化合物分子的电子数相等。请回答:
(1)写出四种元素的符号:A ,B ,C ,D 。
(2)B4A3D2的化学式为 ,所含化学键类型有 。
(3)已知液态X和B2A相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为 。
(4)最简式为BA的液体能使酸性KMnO4溶液褪色,写出相应的离子方程式
。
(5)最简式为BA的液体被称为绿色氧化剂的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)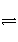
 2HI(g)。在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图所示的正确判断是( )
2HI(g)。在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图所示的正确判断是( )
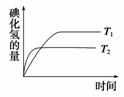
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com