
| ����� | 1 | 2 | 3 | 4 |
| ����KMnO4��Һ���/mL | 20.70 | 20.12 | 20.00 | 19.88 |
���� ��һ���ܶȻ�����ʽ��ͬʱ���ܶȻ�С�������ɳ�����
NaNO2˵��Ϊǿ�������Σ������������ˮ�����Һ��ʾ���ԣ�
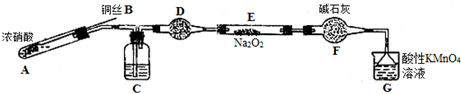
������װ��A����Ũ�����ͭ���ȷ����ķ�Ӧ����Ӧ���ɶ�������������ͭ��ˮ��װ��C����Aװ�����ɵĶ���������ˮ��Ӧ���������һ��������ͨ��װ��D�еĸ��������ˮ������ͨ��װ��F�еĸ������ֹˮ�������룬ͨ��װ��E�еĹ���������һ��������Ӧ�����ͨ�����Ը��������Һ��ȥʣ��һ��������ֹ��Ⱦ������
��1����ͨ�������ƶ�ͭ˿���Ʒ�Ӧ�Ƿ���У�
��2��Ũ�����ͭ���ȷ�����Ӧ���ɶ�������������ͭ��ˮ��װ��C����Aװ�����ɵĶ���������ˮ��Ӧ���������һ��������ͨ��װ��F�еĸ������ֹˮ�������룮
��3���ٸ���c�����⣩=$\frac{c��������V������}{V�����⣩}$��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
�ڸ÷�Ӧ������������ӱ�����Ϊ��������ӣ�����������ӱ���ԭΪ�����ӣ�
�۸��ݷ���ʽ5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O������������Ƶ����ʵ�����Ȼ������Ʒ���������Ƶ�����������
��� �⣺��һ���ܶȻ�����ʽ��ͬʱ���ܶȻ�С�������ɳ����������ܶȻ�����֪Ksp��AgNO2����Ksp��AgCl��������NaCl�����ɳ�����
NaNO2˵��Ϊǿ�������Σ������������ˮ�����Һ��ʾ���ԣ���ˮ�ⷽ��ʽΪNO2-+H2O?HNO2+OH-��
�ʴ�Ϊ��NaCl��NO2-+H2O?HNO2+OH-��
��������1����ͨ�������ƶ�ͭ˿���Ʒ�Ӧ�Ƿ���У�����ʹ��ͭ˿���ŵ��ǿ��Կ��Ʒ�Ӧ�ķ�����ֹͣ��
�ʴ�Ϊ�����Կ��Ʒ�Ӧ�ķ�����ֹͣ��
��2��Ũ�����ͭ���ȷ�����Ӧ���ɶ�������������ͭ��ˮ������ʽΪ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��ͨ��װ��C�е�ˮ�����������Ӧ���������һ��������ͨ��װ��F�еĸ������ֹˮ�������룬��������Ʒ�Ӧ��
�ʴ�Ϊ��Cu+4HNO3��Ũ��=Cu��NO3��2+2NO2��+2H2O��C����ֹˮ�������룻
��3����a����ƿϴ����δ�������Һ�����ʵ������䣬��V��������Ӱ�죬����c�����⣩=$\frac{c��������V������}{V�����⣩}$֪��c���������䣬��a����
b����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ����Һ��Ũ��ƫС�����V������ƫ����c�����⣩=$\frac{c��������V������}{V�����⣩}$֪��c������ƫ��b��ȷ��
c���ζ��յ�ʱ���Ӷ��������V������ƫ����c�����⣩=$\frac{c��������V������}{V�����⣩}$֪��c������ƫ��c��ȷ��
��ѡbc��
�ڸ÷�Ӧ������������ӱ�����Ϊ��������ӣ�����������ӱ���ԭΪ�����ӣ����ӷ���ʽΪ2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O��
�ʴ�Ϊ��2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O��
�����ĸ�����ص����ʵ�����0.1mol/L��0.02L=0.002mol������ݷ���ʽ5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O��֪���������Ƶ����ʵ�����0.002mol��$\frac{5}{2}$=0.005mol����ԭ��Ʒ���������Ƶ����ʵ�����0.005mol��$\frac{100mL}{25mL}$=0.02mol��������Ϊ0.02mol��69g/mol=1.38g��������Ʒ���������Ƶ��������� $\frac{1.38g}{2g}$��100%=69.0%��
�ʴ�Ϊ��69.0%��
���� ���⿼�������Ʊ����漰����ˮ�⡢�����Ʊ���ʵ�������ʵ�����ۡ���ѧ����ʽ�йؼ����֪ʶ�㣬���ؿ���ѧ�������жϡ������֪ʶ���ۺ������������״���������������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ���� | �Թ�a���Լ� | �Թ�b���Լ� | ����л���ĺ��/cm |
| A | 3mL�Ҵ���2mL���ᡢ1mL18mol•L-1 Ũ���� | ����Na2CO3��Һ | 5.0 |
| B | 3mL�Ҵ���2mL���� | 0.1 | |
| C | 3mL�Ҵ���2mL���ᡢ6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL�Ҵ���2mL���ᡢ���� | 1.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Q1+Q2��2Q3 | B�� | Q1+Q2��2Q3 | C�� | Q1+Q2��Q3 | D�� | Q1+Q2��Q3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
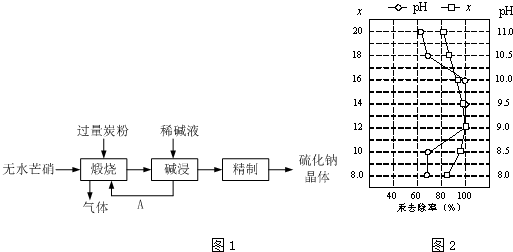
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
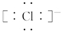 ��Al��Ԫ�����ڱ����е�λ���ǵ������ڵ�IIIA�壮
��Al��Ԫ�����ڱ����е�λ���ǵ������ڵ�IIIA�壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �� | D�� | ȫ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol H+���еĵ����� | |
| B�� | ��״���£�22.4L�ƾ������ķ����� | |
| C�� | 1.6 g CH4 ��������� | |
| D�� | 1L 1mol/L����������Һ������Na+ �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com