
| A. | Na+、K+、Mg2+、SO42- | B. | Ba2+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、S2-、CO32- | D. | Na+、S2- ClO-、Cl- |
 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
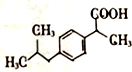
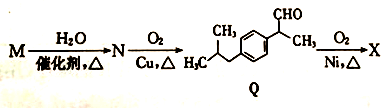
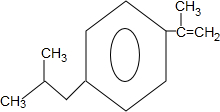 +H2O$→_{△}^{催化剂}$
+H2O$→_{△}^{催化剂}$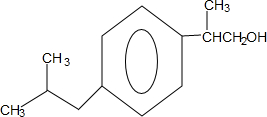 .
. 或
或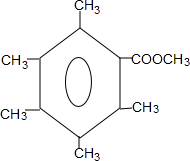 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
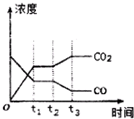 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 单位时间内生成0.5molA的同时,消耗1molC | |
| D. | V(C正):V(D正)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
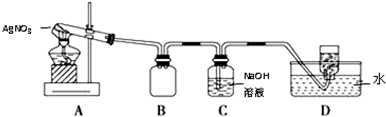
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若R(OH)n为强碱,则W(OH)n+1也为强碱 | |
| B. | 若最高氧化物的水化物HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液与双氧水混合:SO32-+2H2O2=SO42-+2H2O+O2↑ | |
| B. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O=Fe(OH)2↓+2HClO | |
| C. | NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 碳酸氢钙溶液中加入少量的氢氧化钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com