
| A. | 100mL | B. | 101mL | C. | 119mL | D. | 120mL |
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O中含有的分子数为NA | |
| B. | 28g N2中含有的分子数为NA | |
| C. | 1mol Mg与足量稀盐酸反应转移的电子数为NA | |
| D. | 1L 1mol•L-1 Na2 CO3溶液中含有的钠离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
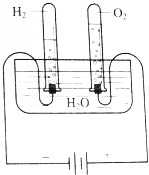 (1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?
(1)根据图所示的电解水原理进行实验,观察不同时间试管内的气体体积的变化.生成的O2和H2体积的比各约为多少?| 质量g | 物质的量 | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类在一定条件下可以水解生成乙醇和二氧化碳 | |
| B. | 检验淀粉在稀硫酸催化条件下水解产物的方法:取适量水解液于试管中,加入少量新制Cu(OH)2溶液,加热,观察是否出现砖红色沉淀 | |
| C. | 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 蛋白质在紫外线、CuSO4溶液、福尔马林作用下均会发生变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


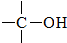 +
+ $→_{△}^{H_{2}SO_{4}(浓)}$
$→_{△}^{H_{2}SO_{4}(浓)}$ +H2O
+H2O +R′CHO$\stackrel{一定条件}{→}$
+R′CHO$\stackrel{一定条件}{→}$
 .
. .
. .
.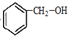 ,名称是苯甲醇.
,名称是苯甲醇. .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 、
、 .
.| 实验操作 | 实验现象 |
| 取KI溶液于试管中,向其中加入少量或适量氯水 向上述溶液中加入CCl4(或加滴淀粉)振荡、静置 (或淀粉-KI溶液或淀粉-KI试纸→必须润湿) 或在淀粉-KI试纸上滴加氯水 | 分层,上层几乎无色,下层紫红色 (试纸变蓝) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都导致浓度偏大 | B. | ①导致浓度偏小,②导致浓度偏大 | ||
| C. | 都导致浓度偏小 | D. | ①导致浓度偏大,②导致浓度偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com