
【题目】3-四氢呋喃甲醇是合成农药呋虫胺的中间体,其合成路线如下:

已知:① RCl ![]() NCN
NCN ![]() RCOOH
RCOOH
② R1COOR2 + R318OH ![]() R1CO18OR3 + R2OH
R1CO18OR3 + R2OH
③ R1COOR2 ![]() R1CH2OH + R2OH
R1CH2OH + R2OH
请回答下列问题:
(1)A生成B的反应类型是__________,B中含有的官能团是___________。
(2)D发生酯化反应生成E的化学方程式为___________。
(3)3-四氢呋喃甲醇有多种同分异构体,请写出其中两种符合下列条件的有机物的结构简式:______________________。
①能发生水解反应 ②分子中有3个甲基
(4)G的结构简式为__________。
(5)生成G的过程中常伴有副反应发生,请写出一定条件下生成高分子聚合物的化学方程式:________。
(6)还可以利用![]() 与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。
与K发生加成反应合成3-四氢呋喃甲醇,写出K和H的结构简式。___________________、__________________。

【答案】取代反应 氯原子(-Cl)、羧基(-COOH) HOOCCH2COOH+2 CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2H2O
CH3CH2OOCCH2COOCH2CH3+2H2O 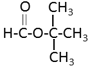 、
、 、
、 (任写2种)
(任写2种) 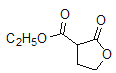 n
n
![]()
 +(n-1)CH3CH2OH HCHO
+(n-1)CH3CH2OH HCHO 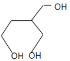
【解析】
由A的分子式、C的结构,结合反应条件,可知A为CH3COOH,A与氯气发生甲基上的取代反应生成B,B为ClCH2COOH,B发生羧基与碳酸钠复分解反应、再发生取代反应生成C。由F的结构、结合信息①,可知C酸化生成D,D为HOOCCH2COOH,结合(2)的提示,D与乙醇发生酯化反应生成E,E为CH3CH2OOCCH2COOCH2CH3;E与环氧乙烷发生开环加成生成F。F发生信息②中酯交换反应脱去1分子CH3CH2OH生成G,故G为 ,G发生信息③中的反应生成
,G发生信息③中的反应生成 ,然后脱去1分子水生成
,然后脱去1分子水生成 ,据此分析解答。
,据此分析解答。
(1)A生成B是乙酸的甲基上H原子比氯原子替代,属于取代反应;B为ClCH2COOH,B中含有的官能团是:羧基、氯原子,故答案为:取代反应;羧基、氯原子;
(2)D为HOOCCH2COOH,D与乙醇发生酯化反应生成E,反应化学方程式为HOOCCH2COOH+2 CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2 H2O,故答案为:HOOCCH2COOH+2 CH3CH2OH
CH3CH2OOCCH2COOCH2CH3+2 H2O,故答案为:HOOCCH2COOH+2 CH3CH2OH![]() CH3CH2OOCCH2COOCH2CH3+2 H2O;
CH3CH2OOCCH2COOCH2CH3+2 H2O;
(3)3-四氢呋喃甲醇的两种同分异构体符合下列条件:①能发生水解反应,说明含有酯基,②分子中有3个甲基,可以是: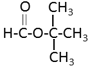 、
、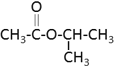 、
、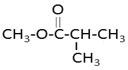 ,故答案为:
,故答案为: 、
、 、
、 (任写2种);
(任写2种);
(4)根据上述分析可知,G为: ,故答案为:
,故答案为: ;
;
(5)生成G的过程中常伴有副反应发生,一定条件下生成高分子聚合物的化学方程式:n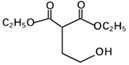
![]()
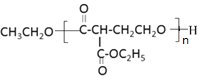 +(n-1)CH3CH2OH,故答案为:n
+(n-1)CH3CH2OH,故答案为:n
![]()
 +(n-1)CH3CH2OH;
+(n-1)CH3CH2OH;
(6)![]() 与K发生加成反应生成
与K发生加成反应生成 ,故K为HCHO,
,故K为HCHO, 发生信息③中反应生成H为
发生信息③中反应生成H为 ,然后脱去1分子水生成
,然后脱去1分子水生成 ,故答案为:HCHO;
,故答案为:HCHO; 。
。


科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(取近似值)
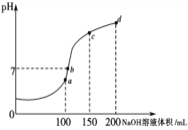
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验兴趣小组的同学从海带中提取碘单质的实验流程图如下:

依据实验下列说法不正确的是( )
A. 从上述实验可以得出海带中含有可溶性的含碘化合物
B. 步骤⑤中可能发生的反应为:5I- + IO3- +6H+ ===3I2 +3H2O
C. 若步骤④中用CCl4做萃取剂,步骤⑥应取上层溶液得到后续的混合物C
D. 整个过程中的操作是利用了物质的溶解性实现了碘元素的富集、分离与提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应:
①若所含溶质的物质的量相等,则生成沉淀的物质的量之比是 _________ ;
②若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量之比是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A. 加入催化剂,B的转化率增大 B. 减小容器体积,平衡不移动
C. 增大c(A),A的转化率增大 D. 降低温度,v正 增大,v逆 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A是固体金属单质,燃烧时火焰呈黄色,B为淡黄色固体。请回答下列问题:

(1)写出下列转化的化学方程式:
B→D_____。
A→C_____。
B→C_____。
(2)写出B物质的一种重要用途___。
(3)A的保存方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com