
分析 (1)同周期从左到右第一电离能逐渐增大,同周期第ⅡA和第ⅤA主族比相邻的都要大,同主族从上往下逐渐减小;
(2)电负性大小与非金属性的强弱一致,根据电负性的变化规律作答;
(3)能层序数相同时,能级越高,能量越高;能级符号相同时,能层序数越大,能量越高,以此规律判断;
(4)一般情况下,主族序数=原子核外电子数(价电子数)=元素的最高化合价,但有例外如F、O.
解答 解:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而增大,Na和Mg位于同一周期,且Na位于第ⅠA族、Mg位于第ⅡA族,Mg的价电子排布式为3s2全满稳定,所以第一电离能Na<Mg,同一主族,从上到下,元素的第一电离能逐渐减小,Mg、Ca都位于第ⅡA族,镁元素属于第三周期,钙元素属于第四周期,所以第一电离能Mg>Ca,
故答案为:<;>;
(2)电负性最大的为F,同周期自左到右电负性逐渐增大,所以电负性O<F,同主族元素自上而下电负性逐渐减小,故电负性F>Cl,
故答案为:<;>;
(3)能级符号相同时,能层序数越大,能量越高,故ns<(n+1)s,能层序数相同时,能级越高,能量越高,故ns<np,
故答案为:<;<;
(4)一般情况下,主族序数=原子核外电子数(价电子数)=元素的最高化合价,但有例外如F、O,
故答案为:=;=.
点评 本题考查第一电离能、电负性、能量变化等规律,熟知这些规律和特例是解题的基础,题目难度不大.


科目:高中化学 来源: 题型:解答题
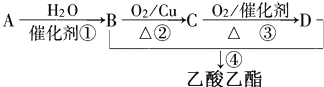
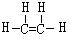 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 高温下,0.3molFe与足量水蒸气反应,生成的H2的体积为8.96L | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 标准状况下6.72 L NO2与水反应转移的电子数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
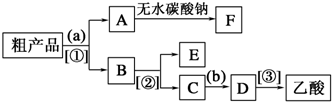
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
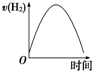 镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )
镁是生产铝合金必需的添加材料.镁合金被公认为“21世纪绿色环保新型材料”,可广泛运用于航空航天、汽车等10多个领域.现把镁条投入到盛有盐酸的敞口容器中,产生H2的速率如图所示.在下列因素中对产生H2速率有影响的是( )| A. | 镁条的质量 | B. | 镁条的表面积 | C. | Cl-的浓度 | D. | 压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钠中铁显+6价 | |
| B. | 湿法中每生成1 mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1 mol Na2FeO4转移3 mol电子 | |
| D. | Na2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
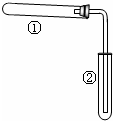 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 |
| 铁粉与水蒸气加热 | 肥皂水冒泡 |
| 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| NaHCO3 | 澄清石灰水变浑浊 |
| 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com