
| A. | 推广使用无磷洗衣粉主要是为了防止水体富营养化 | |
| B. | 高铁酸钾(K2FeO4)是一种新型自来水处理剂,有强氧化性可消毒杀菌,其还原产物能吸附水中杂质 | |
| C. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| D. | 测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振氢谱、同位素原子示踪法等 |
分析 A、水体富营养化是水中植物吸收了磷元素而大量繁殖,而使水中鱼类缺氧死亡,造成水质变坏.
B、根据高铁酸钾的化学式 K2FeO4,从物质所含元素的化合价来分析氧化性还原性问题,利用离子的水解产物的性质来分析净水原因;
C、物理变化和化学变化的根本区别在于是否有新物质生成;
D、质谱仪其实是把有机物打成很多小块,会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量;
解答 解:A、水中磷元素可能来源于周围居民使用的洗衣粉中,则应减少含磷洗衣粉的使用,防止水体污染,故A正确;
B、高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,故B正确;
C、裂解是石油化工生产过程中,以比裂化更高的温度(700℃~800℃,有时甚至高达1000℃以上),使石油分馏产物(包括石油气)中的长链烃断裂成乙烯、丙烯等短链烃的加工过程,属于化学变化;煤的气化是煤与碳反应生成一氧化碳和氢气,属于化学变化;海水制镁由镁离子生成镁单质;火棉就是硝酸纤维,是硝酸和纤维素发生酯化反应生成的等;以上过程中都有新物质生成,包含化学变化,故C正确;
D、质谱仪其实是把有机物打成很多小块,会有很多不同的分子量出现,其中最大的那个就是该有机物的分子量,不能测定结构,故D错误;
故选D.
点评 本题主要考查了研究有机物组成与结构的方法、物质的用途等知识,比较基础,侧重对基础知识的巩固,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题

 ;该微粒的表示符号为O2-.
;该微粒的表示符号为O2-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开化学键的过程会放出能量 | |
| B. | 氧化反应均为吸热反应 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 放热反应中,反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
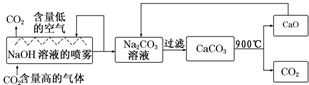
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,O.1 mol•L-1HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中滴加过量盐酸:AlO2-+H++H2O=A1(OH)3↓ | |
| B. | 碳酸氢钠溶液与少量的石灰水:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 向三氯化铁溶液中加入过量铜屑:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | 用NaOH溶液吸收少量Cl2气体:OH-+Cl2=Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | p点横坐标为120 | |
| C. | p点中溶质为Ba(HCO3)2 | |
| D. | ab段反应可分两段,离子方程式依次为:CO2+2OH-=H2O+CO32- CO2+H2O+CO32-=2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
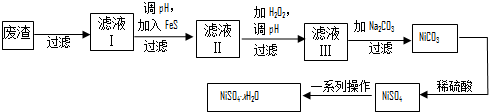
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com