
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、4个 | B、3个 | C、2个 | D、1个 |
| 2ax |
| a-ax+2ax |
| 2ax |
| a-ax+2ax |


科目:高中化学 来源: 题型:
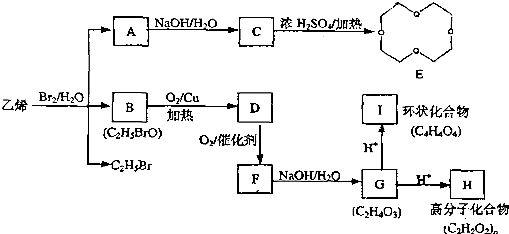
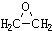 )的结构可简写为
)的结构可简写为 ,则E的分子式是
,则E的分子式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

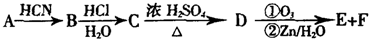
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称量时,将NaOH固体直接放在天平托盘上面的纸上 |
| B、将称好的NaOH固体直接放入容量瓶中,加入少量水溶解 |
| C、在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中 |
| D、将烧杯中已冷却的NaOH溶液注入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| M |
| M |
| 选 项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | NaOH | Na2SO3 | NaHSO3 | SO2 |
| C | Al2O3 | NaAlO2 | Al(OH)3 | NaOH |
| D | Mg | C | CO | CO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、地下钢管连接镁块 |
| B、金属护拦表面涂漆 |
| C、枪炮表面涂上一层油 |
| D、水中的钢闸门连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
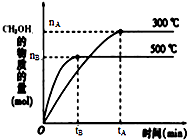 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com