
����Ŀ���������մɳ����ں�Ĥ���ɵ�·���Ʊ��������մɵĺϳ�·����ͼ��ʾ���ش��������⡣
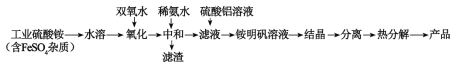
��1�������������跢�������ӷ���ʽΪ��___��ʹ��˫��ˮ���������ŵ�Ϊ___��
��2�����ȷֽ⡱�õ��IJ�������������⣬����NH3��N2��SO2��SO3��H2O���ɣ�����������ͻ�ԭ��������ʵ���֮��Ϊ___��
��3�����������Ļ�ѧʽΪNH4Al(SO4)2��12H2O�����ȷֽ⡱�����У�����¶ȶ������ȡ�ʧ�ؼ���ֵ����ʧ�ؼ���ֵ%=![]() ��100%�������ʾ��
��100%�������ʾ��
�¶����䣨�棩 | 18��190 | 190��430 | 430��505 | 505��900 |
ʧ�ؼ���ֵ��%�� | 39.20 | 7.80 | 13.00 | 26.00 |
ͨ���������ݾ����Լ�����жϣ����¶�����___�����������ʧȥ��ȫ���ᾧˮ��
��4�����ᾧ�������г����õIJ�����___��
��5���ϳɹ����г�ʹ�ù����Ĺ�ҵ����泥��������������Һˮ������������������ˮ�⣬�����һ����Ҫ������___��
��6��ͨ����Ϊ��������Ũ�ȵ���1��10-5mol/L������Ϊ������ȫ���Լ��㳣���¡��к͡���������Ҫ������ҺpH=___������һλС������֪��Ksp[Fe(OH)3]=8.0��10��38��lg5=0.7����
���𰸡�2Fe2++H2O2+2H+=2Fe3++2H2O ��ԭ����Ϊˮ�����������ʡ�����Ⱦ���� 1��3 190��430 ����Ũ������ȴ�ᾧ ��ʹ���������ת��Ϊ������������������������ 3.3
��������
��1��������������������H2O2�������Խ�Fe2+����ΪFe3+��ͬʱH2O2����ԭΪH2O�����������ʡ�����Ⱦ������
��2����������ΪN2����ԭ����ΪSO2�����õ�ʧ�����غ���м��㣻
��3������������Ϣ������������������ʧȥ��ȫ���ᾧˮʱ��ʧ�ؼ���ֵ��
��4������Һ���������壬һ��������Ũ������ȴ�ᾧ��
��5���ϳɹ����г�ʹ�ù����Ĺ�ҵ����泥��������������Һˮ������������������ˮ�⣬�����һ����Ҫ���ÿ��ԴӴ�ԭ�������ʵĽǶȻش�
��6������������Ϣ���������ȫ������ʱ����Ҫ���ڵ�pH��
��1��������������������H2O2�������Խ�Fe2+����ΪFe3+��ͬʱH2O2����ԭΪH2O�������ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��ʹ��˫��ˮ���������ŵ��ǻ�ԭ����Ϊˮ���������ʡ�����Ⱦ������
��2����������ΪN2����ԭ����ΪSO2�����õ�ʧ�����غ���ʽ���£�n(N2)��2��3e����n(SO2)��2e�������n(N2):n(SO2)��1:3��
��3��NH4Al(SO4)2��12H2O�ᾧˮ�ĺ�������Ϊ47.7%��ǰ�����¶ȶ��ڣ���ʧ�ؼ���ֵ��֮��Ϊ39.20%+7.80%��47%������190��430�¶ȶ��ڣ������������ʧȥ��ȫ���ᾧˮ��
��4���õ����ᾧˮ�ľ��峣���õķ���������Ũ������ȴ�ᾧ��
��5��ʹ����粒�������������������ַ�Ӧ��������������������ʣ�
��6�����������������ܶȻ�������֪1��10��5��c3(OH��)��8.0��10��38�����c(OH��)��2��10��11��mol/L����![]() ��pH��4-lg5��3.3��
��pH��4-lg5��3.3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� NA Ϊ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A.��״���£�22.4 L �ױ������ķ�����ԼΪNA
B.�����£�2.8g ��ϩ���ϩ�Ļ�����к�̼ԭ�ӵ���ĿΪ 0.2NA
C.1 mol C3H8 �����к��й��ۼ�����ĿΪ 9 NA
D.1 mol ���������������ڹ��������·�Ӧ������ 2 NA ���Ȼ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ���о���һ�������Ϲ������C3N4/CQDs����������̫�����Ч�ֽ�ˮ��ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
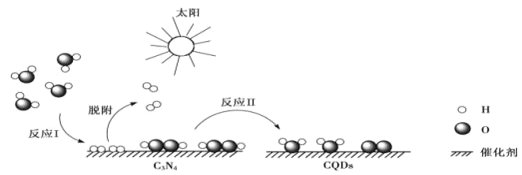
A.H2O2�д��ڷǼ��Թ��ۼ����ǷǼ��Է���
B.��Ӧ�����漰�����Լ��Ķ��ѺͷǼ��Լ����γ�
C.�Ǽ��Է�����һ���зǼ��Լ������Է�����һ���м��Լ�
D.H2O���ڴ��ڷ��Ӽ�������ȶ���ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ijŨ��H2A��Һ�еμ�NaOH��Һ��������pC=��lgC������pC��H2A����pC��HA-����pC��A2-���仯��ͼ��ʾ������˵����ȷ���ǣ� ��
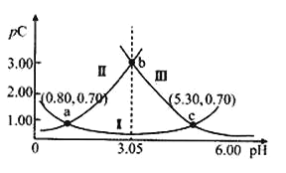
A.����II��ʾpC��HA-����pH�ı仯
B.�����£�![]() =104.50
=104.50
C.����Ũ�ȵ������Na2A��H2A��Һ��Ϻ���Һ�Լ���
D.a��b��c�����Ӧ����Һ��c(HA-)+c(A2-)+c(HA)ʼ�ղ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ӵĽṹ��һ���������壬���������У���֤����������( )
A.![]() ����ֻ��һ��B.
����ֻ��һ��B.![]() ����ֻ��һ��
����ֻ��һ��
C.�������ĸ����ۼ�������ͬD.̼ԭ�Ӻ��ĸ���ԭ�ӵľ���һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ����ͭ����(![]() )��xֵ��ʵ��������£�
)��xֵ��ʵ��������£�

(1)������������ѡ����������(�ñ����ĸ��д)_______________________��
A. ������ƽ B. �Թܼ� C. �ƾ��� D. ������ E. ���� F. ʯ����
(2)���ز���ʱ���������γ����Ľ��������_____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣������г��ˢ�~��Ԫ�ء�
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� |
��Ԫ�ط��Ż�ѧʽ��д���пո�
(1)��~��Ԫ���У�ԭ�Ӱ뾶����Ԫ����_______(��Ԫ�ط���)������������Ӧˮ������������ǿ��������____________________(����Ļ�ѧʽ)��
(2)�ٵ���̬�⻯��ĵ���ʽΪ_________________��
(3)��~��Ԫ���У��۵���������ļ���______�ܵ���������(�����ڡ�С�ڻ������)���ڵ��⻯���ȶ���______�ߵ��⻯��(�����ڡ�С�ڻ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ,��1.0L c mol��L-1 CH3COOH��Һ��0.1mol NaOH�����ϣ�ʹ֮��ַ�Ӧ��Ȼ����û����Һ��ͨ��HCl��������NaOH����(����������¶ȱ仯)����ҺpH��ͨ��(�����)���ʵ����ʵ����ı仯��ͼ��ʾ�����������������( )
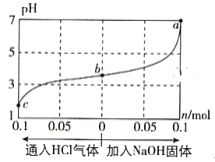
A. ˮ�ĵ���̶ȣ�a>b>c
B. c���Ӧ�Ļ����Һ�У�c(CH3COOH)>c(Na+)>c(OH-)
C. a���Ӧ�Ļ����Һ�У�c(Na+)=c(CH3COO-)
D. ���¶��£�CH3COOH�ĵ���ƽ�ⳣ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������[KAI(SO4)212H2O]��һ����Ҫ�Ļ�����Ʒ���������������ж��й㷺����;��
ij�����ƻ������������ķ�������(��Al��A12O3������SiO2��FeOxFe2O3)Ϊԭ������������Ʒ����Ƶ����������������£�
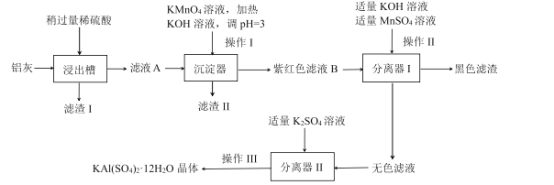
��֪��![]()
��ش��������⣺
(1)������ҺA���Ƿ����Fe2+������K3[Fe(CN)6]��Һ����д�����������ӷ�Ӧ����ʽ____��
(2)�������м���KMnO4��Һ��������____��������Ϊ���������̽�Ϊ���ӣ�������____��Һ(�ѧʽ)����KMnO4��Һ��ʹ������Ͳ�������̵õ��Ż���
(3)�������� ___��____(���������)�����ˡ�ϴ�ӣ���ϴ�Ӿ���ʱ���õ�ϴ�Ӽ�����ʵ��� ___(����ȷ�𰸱��)��
A.ϡ���� B.����ˮ C.70%�ƾ�
(4)����������ˮ�����侻ˮԭ���� ____�����ӷ���ʽ��ʾ)��
(5)�ڳ������е�pH=3�������˵��Fe3+�Ƿ���ȫ����(��Fe3+����Ũ��С�ڻ����1.0x 10-5 mol/Lʱ��������Ϊ��Һ��������)____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com