工业合成氨的反应为:N
2(g)+3H
2(g)?2NH
3(g)△H<0某实验将3.0mol N
2(g)和4.0mol H
2(g)充入容积为10L的密闭容器中,在温度T
1下反应.测得H
2的物质的量随反应时间的变化如图所示.

(1)反应开始3min内,H
2的平均反应速率为______
(2)计算该条件下合成氨反应的化学平衡常数(写出计算过程,结果保留2位有效数字)______.
(3)仅改变温度为T
2( T
2小于T
I)再进行实验,请在答题卡框图中画出H
2的物质的量随反应时间变化的预期结果示意图______.
(4)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H
2O(g)

CO+H
2;②CO+H
2O(g)

CO
2+H
2;
已知CO(g)+

O
2(g)═CO
2(g)△H=-283.0KJ/mol;
H
2(g)+

O
2(g)=H
2O(g)△H=-285.8KJ/mol;
写出上述CO与H
2O(g)反应的热化学方程式:______
(5)合成氨工业中,原料气(N
2,H
2混有少量CO,NH
3)在进入合成塔之前,用醋酸二氨合铜(I)溶液来吸收CO其反应为:
CH
3COO[Cu(NH
3)
2]+CO+NH
3?CH
3COO[Cu(NH
3)
3]?CO△H<0写出提高CO吸收率的其中一项措施:______.


 CO+H2;②CO+H2O(g)
CO+H2;②CO+H2O(g) CO2+H2;
CO2+H2; O2(g)═CO2(g)△H=-283.0KJ/mol;
O2(g)═CO2(g)△H=-283.0KJ/mol; O2(g)=H2O(g)△H=-285.8KJ/mol;
O2(g)=H2O(g)△H=-285.8KJ/mol;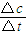 计算反应速率;
计算反应速率; =0.080mol/(L?min),
=0.080mol/(L?min), =
=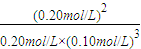 =2.0×102 (L/mol)2;
=2.0×102 (L/mol)2;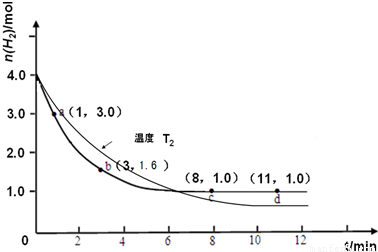 ,
, ;
;



 (1)写出设备A、B的名称:A
(1)写出设备A、B的名称:A